Carrière de St-Germain-sur-Meuse : 5. Annexe I
Le procédé SOLVAY : la fabrication de carbonate et bicarbonate de soude (fig.12)
Le procédé Solvay, mis au point par Ernest Solvay en 1863, permet d'obtenir à moindre coût, de grandes quantités de "soude" (carbonate de soude) à partir de matières premières (calcaire et sel) abondantes dans le sous sol.
C'est un procédé chimique en apparence simple si on se contente de regarder l'équation bilan de la réaction :
sel + calcaire --> carbonate de soude + déchets
2 NaCl + CaCO3 → Na2CO3 + CaCl2
Il s'avère néanmoins plus complexe qu'il n'y paraît si on l'étudie plus en détail.
La source de CaCO3 est le calcaire ; il doit être très pur et concentré en CaCO3 et par contre contenir le minimum d'impuretés (peu de Mg2+).
Pendant longtemps le calcaire utilisé dans les soudières Solvay a été exploité à Maxéville près de Nancy (carrières Solvay ouvertes dans les calcaires bajociens de la côte de Moselle). Il vient maintenant des carrières meusiennes de Pagny-sur-Meuse et de St-Germain-sur-Meuse (Calcaires oxfordiens de la côte de Meuse). Ces calcaires présentent une pureté d'environ 98%.
La source de NaCl est le sel gemme du Keuper exploité à Varangéville (54).
La réaction nécessite une base échangeuse d'ions, l'ammoniaque. Celle ci est recyclée et réutilisée.
NaCl + NH3 + CO2 + H2O --> Na+ + Cl- + NH4+ + HCO3- --> NaHCO3 + NH4Cl
Le CO2 nécessaire au procédé est produit par calcination du calcaire dans un four à chaux :
CaCO3 --> CaO + CO2
La chaux produite sert à recycler l'ammoniac :
2NH4Cl + CaO --> 2 NH3 + CaCl2 + H2O
Le chlorure de calcium CaCl2 est un déchet industriel. Son utilité est limitée (ciments, ...).
Le bicarbonate de soude produit peut être utilisé directement ou servir à la production de carbonate de soude.
Le carbonate de soude est obtenu par calcination du bicarbonate de soude dans un four. Cette réaction génère aussi du CO2 qui est réemployé dans le procédé.
2NaHCO3 --> Na2CO3 + CO2 + H2O
Les Soudières Solvay sont installées à Dombasle-sur-Meurthe (54).
Les résidus liquides sont traités par une station d'épuration dédiée avant leur rejet dans la Meurthe. Le contrôle des rejets salins dans le cours d'eau se fait en temps réel, ce qui permet une régulation de leur concentration pour limiter tout risque de pollution.
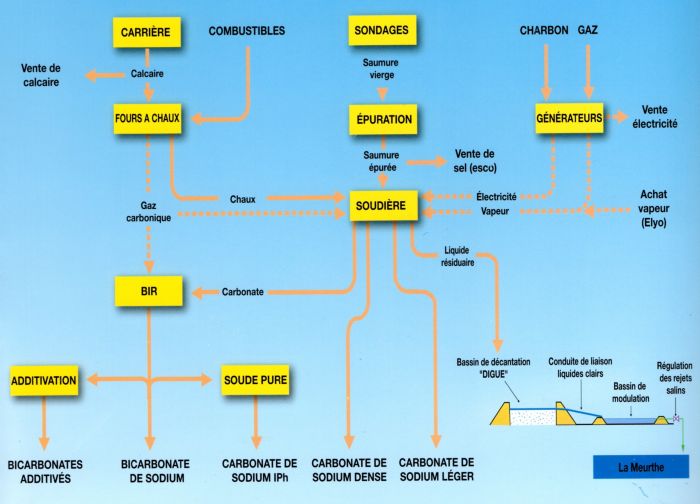
Fig.12: Étapes de fabrication des carbonates / bicarbonates de sodium à la soudière Solvay de Dombasle (document Solvay)
Le carbonate de soude Na2CO3 est utilisé dans l'industrie des détergents, du savon, du verre, ... (fig.13).
Le bicarbonate de soude NaHCO3 est utilisé dans l'industrie alimentaire (poudre à lever), l'industrie pharmaceutique, la production de poudres pour extincteurs ... (fig.13).


Fig.13 : Utilisation du carbonate et du bicarbonate de soude (vitrines de la salle de réunion située dans les bâtiments administratifs de la carrière Solvay).
Auteurs : Philippe MARTIN - Didier ZANY - Date de création : 10/07/2013 - Dernière modification : 27/03/2024


