1.1 MODE OPERATOIRE:
Schéma:
NOTE D'INTRODUCTION :
La démarche "Bidon Futé" permet certes de contribuer à la
préservation de l'environnement en collectant les effluents de travaux pratiques au lieu
de les rejeter à l'évier, mais peut aussi permettre de sensibiliser les élèves au
"comment" du traitement des déchets chimiques et au devenir de ceux-ci après
traitement.
On pourrait ainsi éviter que les "bidons futés" ne deviennent une sorte de
"boîtes noires", équivalents pédagogiques du siphon de l'évier...
Le T.P. proposé ici permet de concrétiser jusqu'à son terme ultime la démarche
"Bidon Futé" de tri sélectif des déchets chimiques, telle qu'elle a été
mise en place au Lycée Louis Vincent de Metz, en faisant appel aux compétences acquises
en classe de seconde.
Il peut faire suite à la visite du pilote de traitement des déchets chimiques situé
dans le laboratoire de Génie Chimique du Lycée ou à une démonstration réalisée en
classe à l'aide du mini-pilote didactique réalisé par le Lycée (renseignements
disponibles sur demande).
Place dans la progression:
Cette séance de travaux pratique pourrait idéalement prendre place en
fin de premier trimestre, une fois achevée la première partie "Chimie des champs et
des jardins" (dont il reprend de nombreuses notions en pré-requis) et après le T.P.
sur la notion d'élément chimique.
La démarche "Bidon Futé" étant en principe appliquée tout au long de
l'année, ce T.P. peut néanmoins être réalisé au moment jugé opportun par chacun.
Polycopié distribué aux élèves:
Les 8 pages suivantes forment le polycopié distribué aux élèves
(nous avons fait figurer en bleu les réponses attendues dans
le cas d'expériences réussies). Il consiste en 2 feuilles A3 recto-verso pouvant
constituer, une fois pliées, un livret format A3.
La 1ére feuille (pages 3,4,9 et 10 ci-après) est distribuée pendant le cours
précédant la séance de T.P. Les pages 3 et 4 sont exploitées en faisant le point sur
la visite du pilote et exploitant les notes prises par les élèves à cette occasion.
La 2éme feuille (pages 5,6,7 et 8) est distribuée en début de séance de
T.P.
Les pages 9 et 10 sont exploitées lors du cours suivant ("débriefing" du
T.P.). C'est l'occasion d'une sensibilisation des élèves aux problèmes
d'écotoxicologie et de long terme et de préciser la notion de déchet.
Réactifs utilisés:
Les solutions ioniques proposées ici ne sont qu'indicatives, chaque
collègue étant libre d'adapter les compositions à sa propre progression. Nous avions
retenu le test de décoloration d'une solution (K+ + MnO4-)
par le zinc en présence d'ions NO3- pour la mise en évidence des
nitrates et le cuivre pour le TP "éléments chimiques". Cela explique notre
choix.
Les concentrations indiquées pour la solution à traiter (voir la liste de produits et
matériel) résultent d'un compromis entre :
- la nécessité d'avoir un gâteau de filtration appréciable et donc un volume de
précipité suffisant
- le soucis d'éviter la formation de MnO2 .
Le zinc est utilisé en poudre plutôt qu'en grenaille afin de diminuer la durée de la
première expérience (aire spécifique beaucoup plus favorable). Il permettra également
de visualiser le gâteau de filtration sur le papier filtre quel que soit le volume de ce
gâteau.
Précautions expérimentales:
Expérience 1: Traitement de la solution oxydante.
3 gouttes d'acide nitrique à 50 % sont suffisantes pour une décoloration en moins de 5
minutes. Davantage d'acide demandera d'autant plus de soude pour neutraliser avant de
pouvoir précipiter les hydroxydes métalliques (expérience 2).
Expérience 2: Précipitation des hydroxydes métalliques.
Ajouter la soude à la solution décantée (ne pas agiter avant l’ajout de la soude)
afin de pouvoir visualiser l'apparition du précipité blanc dans le surnageant (le
phénomène serait moins visible avec la poudre de zinc en suspension).
Les hydroxydes métalliques obtenus ne se redissolvent qu'à pH =14. Il est donc peu
probable de perdre du précipité ainsi.
Expérience 3: Filtration.
. S'il reste un peu de temps il peut être intéressant de traiter le filtrat devant les
élèves:
- ajout d'un peu de soude: on ne devrait en principe voir aucun précipité d'hydroxyde
métallique
- il suffit alors de neutraliser la solution (mesure au papier pH par un élève) avec de
l'acide chlorhydrique (pour éviter de rejeter des ions nitrate) avant de rejeter celle-ci
à l'évier devant les élèves.
Expérience 4: Pluies acides.
La lixiviation est un peu lente. Si le temps presse il est possible de ré-utiliser les
fioles à vide de l'expérience 3 à condition de les rincer soigneusement pour qu'il n'y
ait aucune équivoque sur la provenance du précipité obtenu par ajout de soude au
lixiviat.
INTRODUCTION
Dans le cadre général de l'opération "Bidon Futé", un tri sélectif des déchets chimiques issus des séances de travaux pratiques a été mis en place au Lycée. Selon leur nature, ces déchets sont stockés dans des bidons de différentes couleurs.Rappels:
1/ - Les bidons blancs contiennent un mélange d'acides et de bases. Les solutions doivent être neutralisées (le pH doit être ajusté à une valeur voisine de 7 ) avant d'être rejetées à l’égout. Cette opération est effectuée dans la cuve (C1) (possibilité d’ajout automatique d'une solution acide ou d'une solution basique).
2/ - Les bidons bleus contiennent des cations métalliques. On effectue la précipitation de ces métaux sous forme d'hydroxydes. Cette opération est effectuée dans la cuve (C2). Les ions hydroxyde sont apportés par une solution de lait de chaux ou hydroxyde de calcium ( Ca2+ + 2 HO- ). La solution est ensuite décantée dans la cuve (D). Les boues obtenues sont ensuite filtrées. Elles seront envoyées , après une éventuelle stabilisation en décharge contrôlée . Si les opérations ont été conduites correctement, le filtrat est alors purifié de ses polluants. Il sera envoyé à l’égout après vérification et neutralisation.
3/ - Les bidons jaunes contiennent des oxydants. Il faut "débarrasser" la solution de ce caractère oxydant. On appelle cela une réduction (la théorie sera vue en classe de première). Cette opération est réalisée dans la cuve (C1) (possibilité d’ajout automatique d'une solution réductrice) où on ajuste également le pH pour optimiser la réaction. La suite du traitement est alors similaire au paragraphe précédent (cuves C2 et D).
Nous allons traiter dans le cadre de ce TP le contenu d'un bidon jaune (oxydants), car cela va nous permettre d'examiner plus en détail chacune des étapes décrites ci-dessus.1/ TRAITEMENT DE LA SOLUTION OXYDANTE:
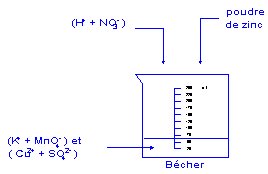
Prendre le petit bidon jaune disponible sur la paillasse. Lire le contenu sur l'étiquette renseignées par les utilisateurs. Le bidon jaune contient: ( K+ + MnO4- ) et ( Cu2+ + SO42- ).1.1 MODE OPERATOIRE: Schéma: |
 |
- verser la moitié du contenu du flacon jaune dans un bécher.
- ajouter quelques gouttes d'acide nitrique concentré à l'aide du compte gouttes.
- ajouter une spatule de poudre de zinc (délicatement pour éviter les projections ).
- agiter doucement
- laisser décanter quelques minutes
A quoi sert l'acide nitrique ? - à obtenir un
pH acide
- à fournir les ions nitrates (catalyseur)
1.2. OBSERVATIONS:
- décoloration du permanganate de potassium
- décoloration du sulfate de cuivre dont la couleur était masquée par celle du
permanganate de potassium.
1.3 INTERPRETATION:
- réaction complexe de décoloration du
permanganate de potassium par le zinc en présence d'ions nitrate NO3-
(cf TP identification des ions)
- réaction des ions Cu2+ avec le
zinc métal (Cu2+ + Zn à Cu + Zn2+
) (cf TP sur l'élément cuivre)
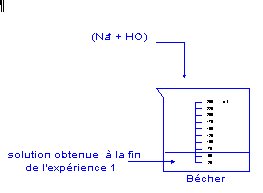
2. PRECIPITATION DES HYDROXYDES METALLIQUES
Pour l'étape de précipitation on utilise sur le pilote du lait de
chaux ( Ca2+ + 2 HO- ). Dans ce T.P. nous allons utiliser une
solution de soude.
Quel est le nom scientifique de la solution de soude ? Quelle est sa formule chimique?
solution d'hydroxyde de sodium ( Na+ + HO- )
Lait de chaux ou soude ne change rien au principe de l'opération: il s'agit dans les deux cas d'apporter des ions hydroxyde.
2.1 MODE OPERATOIRE: Schéma: |
 |
2.2 OBSERVATIONS:
Apparition d'un précipité blanc (ou blanc-rose ) dans le surnageant qui se mélange à la poudre de zinc en suspension.
2.3 INTERPRETATION:réaction de précipitation entre les cations
métalliques présents et les ions hydroxyde
Zn2+ + 2 HO- à Zn(HO)2 (s)
précipité de couleur blanche
Mn2+ + 2 HO- à Mn(HO)2 (s) précipité
de couleur blanc - rose
3. FILTRATION:
3.1 MODE OPERATOIRE: Schéma: |
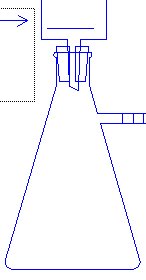 |
- placer le papier filtre sur le büchner., humidifier légèrement le papier
filtre.
- mettre en route la trompe à vide :
a/- ouvrir le robinet d'eau
b/- connecter le tuyau en caoutchouc à la fiole à vide (robinet d'aspiration en
position fermée)
- mettre en suspension le précipité en agitant un peu
- verser le contenu du becher sur le filtre, observer.
- ouvrir le robinet d'aspiration de la trompe à vide, observer.
- quand la filtration est achevée, fermer le robinet d'aspiration, déconnecter le tuyau
en caoutchouc puis fermer le robinet d'eau.
Le filtrat sera récupéré dans un bidon spécial pour vérification et éventuel traitement complémentaire par le professeur avant rejet à l’égout.
3.2 OBSERVATIONS:
- on récupère un filtrat
incolore
- la filtration est beaucoup plus facile avec le robinet d'aspiration ouvert.
- on obtient un gâteau gris foncé.
3.3 INTERPRETATION:
- Les précipités (blancs)sont retenus par le
papier filtre de même que la poudre de zinc (noire)
ð on obtient un gâteau de filtration gris foncé.
- La filtration est facilitée lorsque la fiole est "sous vide". En fait, comme on crée une dépression dans la fiole (c.a.d. que l'on y fait régner une pression inférieure à la pression atmosphérique), c'est la pression atmosphérique qui "pousse" le liquide à travers le gâteau de filtration.
4. SIMULATION DE L'ACTION DES PLUIES ACIDES:
Les gâteaux de filtration peuvent ( et doivent) être stockés
dans des décharges spécialisées. Même enterrés ces déchets seront soumis à l'action
des eaux de pluies (rappelons-nous du lessivage dans le cycle de l'azote). La situation
est même aggravée quand les eaux de pluie sont acides, ce qui est malheureusement assez
fréquent aujourd'hui.
Citer un corps responsable des pluies acides ? le dioxyde d'azote
NO2 (voir le cycle de l'azote )
Nous allons simuler l'action de ces pluies acides sur les gâteaux stockés en
décharge en faisant percoler une solution acide à travers le gâteau.
Remarque: En général les pluies acides sont moins acides que la solution utilisée. Nous
utilisons celle-ci pour accentuer les résultats.
4.1 MODE OPERATOIRE: Schéma: |
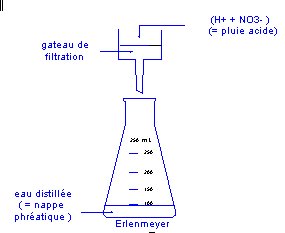 |
- mettre un fond d'eau distillée dans l'erlenmeyer ( pour
simuler la nappe phréatique )
- verser un peu de solution d'acide nitrique sur le gâteau toujours en place sur le
büchner
- à la fin de l'opération ajouter quelques gouttes de soude au contenu de l'erlenmeyer.
Observer.
- effectuer la même opération dans un tube à essai témoin contenant un peu de solution
acide. Observer.
A la fin de l'opération placer les gâteaux de filtration dans la poubelle idoine et
vider les fioles à vide dans le bidon futé approprié. Lequel ?
Bidon bleu (métaux)
4.2 OBSERVATIONS:
Le liquide récupéré dans l'erlenmeyer est
incolore
On observe la formation d'un précipité dans la fiole à vide mais pas dans le tube à
essais.
4.3 INTERPRETATIONS:
Nous avons mis en évidence la présence de
cations métalliques dans la fiole à vide (ici des ions Zn2+
et des ions Mn2+ )Une fraction du gâteau s'est donc redissoute par
ajout d'acide.
Le même phénomène à déjà été constaté lors du TP test d'identification
des ions. Donner un exemple:
redissolution du précipité d'hydroxyde de baryum par ajout
d'acide.
5. CONCLUSION:
Des traitements chimiques permettent de débarrasser les solutions de
leur caractère oxydant, dangereux pour les cellules des organismes vivants (cf.
expérience 1).
D'autres traitements permettent d'éliminer les ions métalliques des eaux à purifier.
Ainsi la précipitation permet de passer d'ions métalliques aqueux, difficilement
isolables, à des précipités d'hydroxydes métalliques (cf. expérience 2), donc solides
et facilement séparables par décantation et par filtration (cf. expérience 3). Ce
procédé est couramment utilisé dans les stations de traitement d'eau.
Si les déchets chimiques solides (p.e. déchets de TP, certaines boues de stations
d'épuration, cendres d'incinérateurs ...) sont placés sans précaution dans une
décharge, l'eau de pluie peut provoquer une dissolution partielle de certains composés
et entraîner ceux-ci vers la nappe phréatique. On appelle ce phénomène la lixiviation
(cf. expérience 4).
(Voir en annexe à titre indicatif les effets écotoxicologiques du sulfate de cuivre et du sulfate de zinc)
Pour éviter ce problème on procède à des tests de lixiviation sur les déchets afin de déterminer si ceux-ci doivent être stabilisés (enrobage à l'aide de matières inertes). Si leur composition le justifie, ils sont ensuite stockés dans des décharges spéciales dites "décharges contrôlées". Celles-ci sont situées sur des sites géologiques particuliers où une couche imperméable du sous-sol permet de protéger les nappes phréatiques. Elles sont par ailleurs équipées d'un système de captage des eaux de ruissellement.
"Nous ne sommes pas les
propriétaires de la planète sur laquelle nous vivons,
nous n'en sommes que les gérants "
(Commandant Jacques Yves Cousteau).
EFFETS ECOTOXICOLOGIQUES DU SULFATE DE ZINC : ( Zn2+ + SO42- )
Concentration dans l'eau |
effet |
période létale |
10 mg.L-1 |
truites |
30 h |
0.6 mg.L-1 |
jeunes saumons |
30 h |
1.5 mg.L-1 |
épinoches |
24 h |
0.4 mg.L-1 |
épinoches |
7 jours |
Période létale: laps de temps durant lequel les poissons sous essai
subissent des lésions telles que le fait de les remettre dans l'eau fraîche ne les
empêchera plus de mourir.
La dose létale est d'autant plus faible que la période d'exposition est longue.
Les effets à très long terme d'exposition à des concentrations très faibles sont
encore mal connus.
EFFETS ECOTOXICOLOGIQUES DU SULFATE DE CUIVRE : ( Cu2+ + SO42- )
Espèces animales ou végétales |
Concentration létale au bout de 4 jours |
certaines algues |
0.1 à 0.5 mg.L-1 |
daphnies |
1 mg.L-1 |
Carpes |
0.35 mg.L-1 |
Saumons adultes |
0.1 mg.L-1 |
Jeunes saumons |
0.05 mg.L-1 |
Lorsque sulfate de cuivre et sulfate de zinc sont mélangés, leurs effets toxiques sont multipliés plusieurs fois !!!
ð Cela doit vous faire réfléchir sur les effets écotoxicologiques du lixiviat obtenu dans la partie n° 4 du T.P.!!!
( source: Les eaux industrielles résiduaires. Meinck, Stooff et Kohlschütter. Masson éditeur )
LISTE DE MATERIEL
PREVOIR POUR CHAQUE BINOME:
- 1 fiole à vide 500 ml avec potence, noix et pince
- 1 büchner avec papier filtre
- 1 trompe à vide (1 par paillasse suffit)
- 1 bécher de 250 ml
- 1 bécher de 50 ml
- 1 agitateur en verre
- 1 éprouvette graduée de 25 ml
- 1 erlenmeyer de 250 ml
- 1 spatule
- 1 pissette d'eau distillée
- 1 tube à essai avec porte-tubes
- du papier essuie-tout
- acide nitrique 50 % en flacon compte-gouttes
- acide nitrique 0.1 M
- soude 5 M en flacon compte-gouttes
- poudre de zinc
- 1 flacon jaune contenant 100 ml (50 ml pour chaque groupe) d'une solution 0.01 M de
permanganate de potassium et 0.1 M de sulfate de cuivre.
POUR L'ENSEMBLE DE LA CLASSE:
- 1 bidon futé bleu
- 1 bidon futé jaune
- 1 bidon futé blanc
- 1 poubelle pour les gâteaux de filtration
- 1 flacon de lait de chaux et d'eau de chaux (pour montrer aux élèves)
![]() Pour Télécharger le TP (zip 64 ko) (word6)
Pour Télécharger le TP (zip 64 ko) (word6)
| |