SPECTROSCOPIE INFRAROUGE :
FRÉOUENCES DES VIBRATIONS DE VALENCE ET DES VIBRATIONS DE DÉFORMATION
préparé par Jean
UMBER Professeur de Chimie
|
RETOUR |
Liaison + environnement |
Nature |
Nbre d’onde (cm–1) |
Intensité (1) |
Valence |
2810 - 3000 |
F |
|
Déformation |
1365 - 1385 |
F |
|
Valence |
3000 – 3100 |
m |
|
Déformation – CH = CH – |
E 1000 - 950 Z 650 - 770 |
F m |
|
Valence |
3030 - 3080 |
m |
|
Déformation hors du plan |
690 – 770 730 - 770 |
F F |
|
Déformation hors du plan |
735 - 770 |
F |
|
Déformation hors du plan |
680 – 725 750- 810 |
m F |
|
Déformation hors du plan |
800 - 860 |
F |
|
Déformation hors du plan |
685 – 720 770- 800 |
m F |
|
Déformation hors du plan |
800 – 860 860 - 900 |
F m |
|
Déformation hors du plan |
675 – 730 810 - 865 |
F F |
|
Valence |
2700 - 2900 |
m |
|
Valence |
3300 - 3310 |
m |
|
| O – H libres | Valence |
3580 - 3670 |
F |
| O – H (alcool avec liaison H) | Valence |
3200 - 3400 |
F |
| O – H (acide carboxylique) | Valence |
2500 - 3200 |
F |
| N – H (amines I : 2 bandes) | Valence |
3100 - 3500 |
m |
| N – H (amines II + imines : 1 bande) | Valence |
3100 - 3500 |
m |
| N – H (amides I : 2 bandes ; amides II : 1 bande) | Valence |
3100 - 3500 |
F |
| N – H (amides ou amines) | Déformation dans le plan |
1560 -1640 | F ou m |
| C – C | Valence |
1000 - 1250 |
F |
| C = C | Valence |
1625 - 1680 |
m |
| C º C | Valence |
2100 - 2250 |
F |
| C = C (aromatique) | Valence |
1600 – 1450 (3 à 4 bandes) |
m |
| Si le cycle est conjugué ces deux bandes subissent un effet bathochrome (– 20 à – 40 cm–1) et elles deviennent F. | |||
| C – O | Valence |
1050 -1450 |
F |
| C = O Aldéhydes + cétones | Valence |
1650 -1730 |
F |
| C = O acides | Valence |
1680 -1710 |
F |
| C = O esters | Valence |
1700 -1740 |
F |
| C = O anhydrides | Valence (2 bandes) |
1780 - 1840 |
F |
| C = O chlorures d'acide | Valence |
1770 - 1820 |
F |
| C = O amides | Valence |
1650- 1700 |
F |
| Toutes les fréquences de vibration de valence des C = O sont abaissées de 20 à 30 cm–1 si elles sont conjuguées. | |||
| C – N | Valence |
1000 - 1400 |
v |
| C = N | Valence |
1600 - 1680 |
|
| C º N | Valence |
2120 - 2260 |
f à m |
| C – F | Valence |
1000 - 1400 |
F |
| C – Cl | Valence |
700- 800 |
F |
| C – Br | Valence |
600 - 750 |
F |
| C – I | Valence |
500 - 600 |
F |
Valence |
1510- 1580 1325 - 1365 |
TF TF |
|
| P = O | Valence | 1250 - 1310 | F |
RÉSONANCE MAGNÉTIQUE NUCLÉAIRE
Table 1 - Déplacement chimique des protons des groupes méthyle, méthylène et méthyne, dans l'échelle d (en ppm ou 10–6) ; le TMS (Me4Si) étant pris comme référence.
| CH3 | CH2 | CH | |||
proton |
d |
proton |
d |
proton |
d |
| CH3 – C | 0,9 | – C – CH2 – C | 1,3 | – C – CH – C | 1,5 |
(cyclique) |
1,5 | (en tête de pont) | 2,2 | ||
| CH3 – C – C= | 1,1 | – C–CH2 – C – C=C | 1,7 | ||
| CH3 – C – O | 1,4 | – C – CH2 – C – O | 1,9 | – C – CH – C – O |
2 |
| CH3 – C=C | 1,6 | – C – CH2 – C=C | 2,3 | ||
| CH3 – Ar | 2,3 | – C – CH2 – Ar | 2,7 | – C – CH – Ar | 3 |
| CH3 – CO – R | 2,2 | – C – CH2 – CO –R | 2,4 | – C – CH – CO – R |
2,7 |
| CH3 – CO – Ar | 2,6 | ||||
| CH3 – CO – OR | 2,0 | – C – CH2–CO–OR | 2,3 | ||
| CH3 – CO – OAr | 2,4 | ||||
| CH3 – CO – NR | 2,0 | ||||
| CH3 – OR | 3,3 | – C – CH2 – OR | 3,4 | – C – CH – OR | 3,7 |
| CH3 – OH | 3,4 | – C – CH2 – OH | 3,6 | – C – CH – OH | 3,9 |
| CH3 – O – Ar | 3,8 | – C – CH2 – O – Ar | 4,3 | ||
| CH3 – O – CO – R | 3,7 | –C–CH2 –O–CO–R | 4,1 | –C–CH –O–CO– R | 4,8 |
CH3 – N – |
2,3 | – C – CH2 – N – | 2,5 | – C – CH – N – | 2,8 |
| CH3 – N+ | 3,3 | ||||
| CH3 – S – | 2,1 | – C – CH2 – S – | 2,4 | ||
| CH3 – C – NO2 | 1,6 |
C–CH2 – NO2 | 4,4 |
C–CH – NO2 | 4,7 |
| C–CH2 – C – NO2 | 2,1 | ||||
CH3 – C=C – CO |
2,0 |
–C–CH2 –C=C–CO |
2,4 |
||
C = C(CH3) – CO |
1,8 |
– C=C(CH3) – CO | 2,4 |
||
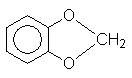 |
5,9 |
||||
CH3 – Cl |
3,0 |
– C – CH2 – Cl |
3,4 |
– C – CH – Cl |
4,0 |
CH3 – C – Cl |
1,5 |
– C – CH2 – C – Cl |
1,7 |
– C – CH – C – Cl |
1,6 |
CH3 – Br |
2,7 |
– C – CH2 – Br |
3,3 |
– C – CH – Br |
3,6 |
CH3 – C – Br |
1,7 |
– C – CH2 – C – Br |
1,7 |
– C – CH – C – Br |
1,7 |
CH3 – I |
2,2 |
– C – CH2 – I |
3,1 |
– C – CH – I |
4,2 |
CH3 – C – I |
1,9 |
– C – CH2 – C – I |
1,8 |
– C – CH – C – I |
1,9 |
| CH3 – CN | 2,0 | – C – CH2 – CN | 2,3 |
– C – CH – CN |
2,7 |
– CO – CH2 – Ar |
3,8 | ||||
0,3 |
0,7 |
||||
| 2,6 | 3,1 | ||||
Table 2 - Déplacement chimique de divers protons : d (en ppm ou 10–6)
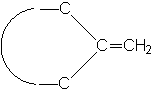 |
4,6 |
|
7,2 |
| – C = CH2 – C = CH – – C = CH – (cyclique) R – C º C – H Ar – H |
5,3 5,1 5,3 3,1 9,0 - 7,0
|
– CO – OH C = C – OH R – OH Ar – OH Ar – OH (liaison H intramoléculaire)
|
8,5 - 13 11 - 17 0 7 ~ 5,5 4,2 ~ 7,1 10 - 14 |
| – C = CH – CO – CH = C – CO |
5,9 6,8 |
R – NH – Ar – NH – |
0,6 ~ 5 2,9 ~ 4,7 |
| R – CHO Ar – CHO H – CO – O – H – CO – N – |
9,9 9,9 8,0 8,0 |
R – CO – NH – CHCl3 H2O |
5 ~ 8 7,2 ~ 5 |
Table 3 : Constantes de couplage J (en Hz ou cps)
|
|
0 | 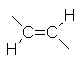 |
11 à 18 | 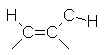 |
0 à 1,5 |  |
6 à 9 |
|
2 à 9 |
|
6 à 14 |
|
0,5 à 2 |
|
1 à 3 |
|
10 à 13 |
|
0,5 à 3,5 |
|
4 à 10 |
|
0 à 1 |
|
1 à 3 |
|
6,7 à 7,2 |
|
5,7 à 6,8 |
Règle de TOBEY. PASCUAL, MEYER, SIMON
Dans l'application de cette règle, chaque substituant a une constante différente suivant son orientation cis, trans ou gem par rapport à l'hydrogène dont on calcule le déplacement chimique
d = 5,28 + sgem + scis + strans
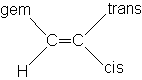
| Groupe | sgem | scis | strans | Groupe | sgem | scis | strans |
| H | 0 | 0 | 0 | -CO2H | 1.00 | 1.35 | 0.74 |
| Alkyl | 0.44 | - 0.26 | - 0.29 | -CO2H (conj.) | 0.69 | 0.97 | 0.39 |
| (CH3) | (0.44) | (- 0.32) | (- 0.34) | -CO2R | 0.84 | 1.15 | 0.56 |
| Cycloalkyl | 0.71 | - 0.33 | - 0.30 | -CO2R (R conj.) | 0.68 | 1.02 | 0.33 |
| -CH2-O- | 0.67 | - 0.02 | - 0.07 | -CHO | 1.03 | 0.97 | 1.21 |
| -CH2-S- | 0.53 | - 0.15 | - 0.15 | -CO-N | 1.37 | 0.93 | 0.35 |
| -CH2-Cl, -CH2-Br | 0.72 | 0.12 | 0.07 | -CO-Cl | 1.10 | 1.41 | 0.99 |
| -CH2-N | 0.66 | - 0.05 | - 0.23 | -OR (R aliph.) | 1.18 | - 1.06 | - 1.29 |
| -CºC- | 0.50 | 0.35 | 0.10 | -OR (R conj.) | 1.14 | - 0.65 | - 1.05 |
| -CºN | 0.23 (0.30) | 0.78 (0.75) | 0.58 (0.53) | -OCOR | 2.09 | - 0.40 | - 0.67 |
| -C=C | 0.98 | - 0.04 | - 0.21 | -Ar (Ph) | 1.35 (1.43) | 0.37 (0.39) | - 0.10 (0.06) |
| -C=C (conj.) | 1.26 | 0.08 | - 0.01 | -Cl | 1.00 (1.05) | 0.19 (0.14) | 0.03 (0.09) |
| -C=O | 1.10 | 1.13 | 0.81 | -Br | (1.02) | (0.33) | (0.53) |
| -C=O (conj.) | 1.06 | 1.01 | 0.95 | -SR | 1.00 | - 0.24 | - 0.04 |
| -NR (R aliph.) | 0.69 | - 1.19 | - 1.31 | -SO2- | 1.58 | 1.15 | 0.95 |
| -NR (R conj.) | 2.30 | - 0.73 | - 0.81 |