1. Structure de la triple liaison.
1.1. Hybridation des carbones.
Les deux carbones concernés sont hybridés sp. Cela entraîne une électronégativité de 3,1 dans l’échelle de PAULING. Ces hybrides sp (2 par carbone, formant entre eux un angle de 180°), vont permettre la création des liaisons s , avec les atomes voisins et entre eux. La liaison s Csp — Csp a une énergie de 470 kJ.mol–1. Elle est donc très stable et courte (0,12 nm). Sur chaque atome de carbone, il reste deux OA non hybridées parallèles deux à deux. Elles vont se recouvrir deux à deux pour donner deux OM p (pz et px par exemple) et deux OM p* (pz* et px*). Les pz et px sont perpendiculaires. Les deux liaisons p sont beaucoup moins stables que la s (175 kJ.mol–1). Au total, l’énergie de la liaison triple C º C vaut 820 kJ.mol–1.
Contrairement à la double liaison, les électrons, sous l’effet de H extérieur, circulent dans les OM p à la manière d’un solénoïde dont l’axe serait la liaison triple, le cône d’anisotropie contient donc les éventuels protons portés par le carbone sp, si bien que ces protons ont un déplacement chimique plus faible que celui attendu, compte tenu de l’électronégativité importante du carbone sp. Le déplacement chimique du proton acétylénique est compris entre 2,4 et 2,7 ppm.
Un monoalcyne est dénommé en remplaçant le suffixe ane par yne : CH3 — CH2 — C º CH : but-1-yne.
2. Propriétés physicochimiques.
2.1. Températures de changement d’état.
Ces hydrocarbures sont très effilés, les forces de Van der Waals sont donc importantes, et les températures de changement d’état plus élevées que celles des alcanes homologues : teb C2H4 = –102°C teb C2H2 = –83°C
L’éthyne (ou acétylène) est obtenu industriellement par réduction du carbonate de calcium par le coke à haute température (vers 1500°C) :
CaCO3 + 3 C
® CO + CaC2 (carbure de calcium,
structure de type NaCl, l’anion étant: ![]() ). Celui-ci s’hydrolyse très
facilement (lampes à acétylène) en éthyne :
). Celui-ci s’hydrolyse très
facilement (lampes à acétylène) en éthyne :
CaC2 + H2O ® Ca(OH)2 + HC º CH
L’enthalpie de combustion de C2H2 est très élevée, la flamme oxyacétylénique pouvant atteindre une température de 2900°C. Aussi la manipulation de l’éthyne est-elle hasardeuse à l’état sec. L’odeur caractéristique de l’acétylène obtenu par hydrolyse provient de l’hydrolyse concommittante du phosphure de calcium, produit parasite de la réaction de CaCO3 avec le carbone contenant du phosphore :
Ca3P2 + H2O ® Ca(OH)2 + PH3 (phosphine nauséabond)
La forte électronégativité du Csp stabilise les charges négatives (plus que ne le fait l’azote par exemple). Le pKA du couple acide/base RC º C — H / RC º C– vaut 25. L’amidure de sodium transformera donc totalement l’alcyne en alcynure. L’hydroxyde de sodium ne donne lieu qu’à un équilibre partiel (RC º CH + OH– ® RC º C– + H2O ). Cet équilibre peut être déplacé vers la droite en précipitant l’anion alcynure avec des cations tels que Cu+ ou Ag+ . On obtient des composés insolubles dans l’eau et de diverses couleurs : CuC º CCu est rouge, RC º CCu est jaune, RC º CAg est blanc. Tous ces composés sont explosifs à sec.
3. Addition électrophile aux alcynes.
Les règles d’orientation et de stéréochimie appliquées aux alcènes s’appliquent également aux alcynes. Ainsi :
CH3 — C º C — CH3 + Br2 ¾ ® CH3 — CBr = CBr — CH3 (E)
L’addition est plus rapide qu’avec les alcènes, vu la faiblesse des liaisons p , et plus exothermique, ce qui entraîne parfois une réaction destructrice : le chlore (et le fluor bien sûr) enflamme l’éthyne.
L’alcyne peut additionner deux moles d’halogènure d’hydrogène
![]()
L’orientation de la deuxième addition est liée aux effets mésomères donneurs du premier brome.
L’addition d’eau et d’acide acétique, acides trop faibles, nécessite un catalyseur : Hg2+ + H2SO4 :
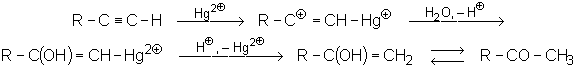
On obtient toujours le carbonyle le plus substitué.
Autre exemple : ![]()
(acétate de vinyle, utilisé pour former des polyacétates de vinyle, matières plastiques).
L’addition de B2H6 suit les mêmes règles d’orientation et de stéréochimie que pour les alcènes. Suivie d’une réaction avec le peroxyde d’hydrogène H2O2 en milieu basique, on obtient une addition d’eau antimarkownikow et syn. Par exemple :
![]()
4.1. Hydrogènation catalytique.
 En
présence de Nickel Raney, les deux insaturations sont hydrogènées. Pour
s’arrêter aux alcènes, il faut utiliser un catalyseur désactivé : Pour cela, on
utilise du palladium pulvérisé avec du sulfate de baryum, le tout imbibé de
quinoléine :
En
présence de Nickel Raney, les deux insaturations sont hydrogènées. Pour
s’arrêter aux alcènes, il faut utiliser un catalyseur désactivé : Pour cela, on
utilise du palladium pulvérisé avec du sulfate de baryum, le tout imbibé de
quinoléine :
L’addition est syn.
![]()
Suivie d’hydrolyse en milieu acétique, elle conduit également à une hydrogènation syn.
Elle est obtenue par action du sodium dans l’ammoniac liquide :
![]()
L’ozonolyse suivie d’une hydrolyse réductrice (CH3COOH , Zn) donne deux acides :
![]()
L’oxydation par K2Cr2O7 ou KMnO4 donne la même chose.
Les alcynes substitués par des groupements attracteurs sont de bons diènophiles :
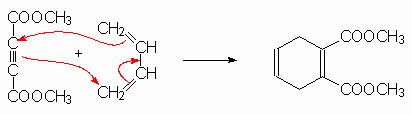
Par contre l’alcyne est un mauvais diène, car il
ne peut se positionner en conformation s-cis. La réaction nécessite une haute
température: ![]() est un mauvais diène.
est un mauvais diène.
La base conjuguée de l’alcyne vrai est une base forte et donc un bon nucléophile dans les solvants aprotiques et les solvants protiques peu polaires.
Cet alcynure peut donner des réactions de substitution nucléophile et d’addition nucléophile.
Les dérivés halogénés (primaires de préférence), réagissent selon une SN2 (voir chapitre suivant)
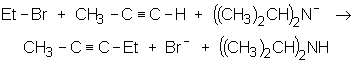
Toujours en présence de base forte, les alcynes s’additionnent aux dérivés carbonylés :
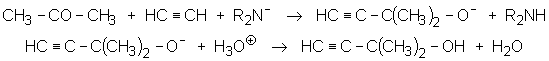
« méthylbutinol »
Traités par NaNH2 , les alcynes disubstitués se transforment en alcynes vrais :
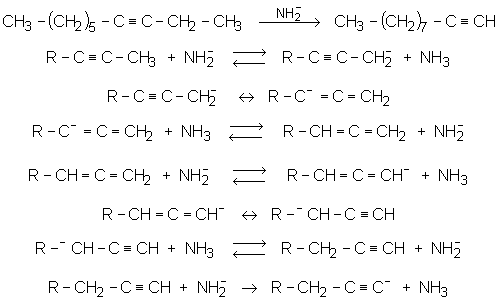
La dernière réaction n’est pas un équilibre, c’est pour cela que la réaction globale est déplacée vers la droite.
En présence de méthylate de sodium MeONa , les alcynes vrais sont eux transformés en alcynes disubstitués. Ces deux réactions demandent une durée très longue (plusieurs heures, voire plusieurs jours).