1. L'atome de chlore.
Les orbitales 3d, vides, ont une énergie proche de celle des 3p. Il y aura influence de ces orbitales sur la réactivité du chlore.
1.2. Potentiel d'ionisation. Électroaffinité.
Le premier est très élevé (1045 kJ/atome-gramme, ou 10,9 eV). Par contre son électroaffinité est négative : l'ion chlorure (non solvaté) est stable par rapport à l'atome. On obtient la structure de l'argon, avec apparition d'une charge relativement faible, d'où cette stabilité :
Mais le chlore, par sa forte polarisabilité due à sa taille importante (rayon covalent = 0,099 nm), donnera beaucoup de composés covalents.
L'électronégativité de Cl est de 3,1 (3,5 pour O).
Mais, s'il est moins électronégatif que O, on verra que est plus oxydant
que
dans l'eau. Le rayon ionique de
et de 0,181 nm.
Il y a deux isotopes importants: d'où Cl = 35,5
Les composés contenant du chlore sont très
facilement détectés en Spectrographie de masse, car tous les fragments contenant
un atome de chlore présentent deux pics distants de deux unités de masse, le
plus lourd ayant une abondance représentant du plus
léger.
2. La molécule de chlore. Propriétés physiques.
2.1. Structure de la molécule.
À priori, on peut représenter la molécule de
chlore par un diagramme d'O.M. classique (voir celui du fluor), avec 4 électrons
dans les deux O.M. antiliantes. Cependant, l'enthalpie de dissociation de (242
kJ/mol) est très supérieure à celle de
(150,5 kJ/mol),
alors qu'à priori, l'augmentation de la distance interatomique devrait diminuer
cette enthalpie de dissociation (c'est d'ailleurs ce qui se passe lorsqu'on
descend ensuite dans la colonne des halogènes :
;
. Que se passe-t-il
?
Les orbitales atomiques 3d du chlore (il n'existe
pas d'O.A. 2d pour le fluor) vont se combiner avec ses 3p. Ainsi, les orbitales
, au
nombre de 4, seront obtenues par combinaison des deux O.A. 3
, ainsi que des
deux O.A.
, qui ont la bonne symétrie. On obtient donc deux O.M.
liantes,
ainsi d'ailleurs que deux O.A.
liantes. Les 8 électrons seront donc disposés dans un
plus grand nombre d'orbitales liantes, et la molécule de chlore sera-t-elle
beaucoup plus stable.
2.2. Formation de Cl à partir de Cl2 .
Propriétés physiques du chlore.
C'est un gaz verdâtre. Sa température d'ébullition est de -35°C. Sa température de fusion est de -105°C. Sa masse molaire de 71g. Il est peu soluble dans l'eau, mais bien plus dans le benzène.
3. Le chlore en solution aqueuse.
3.1. Enthalpie d'hydratation de l'ion chlorure.
L'ion est très solvaté
par les liaisons hydrogène dues à l'eau et l'enthalpie de solvatation vaut
. On en
déduit l'enthalpie de formation de l'ion chlorure solvaté :
est donc un très bon oxydant en solution aqueuse.
3.2. Potentiel rédox du couple Cl2/Cl-
Son potentiel d'électrode vaut 1,36V , supérieur à celui
du couple , cela étant dû à la valeur négative de l'enthalpie de formation de
solvaté. On pourrait donc penser que le chlore puisse oxyder l'eau facilement.
Il n'en est rien, car le couple
est un couple lent
:
En présence de rayonnement ultraviolet, cette réaction s'accélère et l'on peut apercevoir quelques bulles d'oxygène dans les solutions d'eau de chlore exposées au soleil.
3.3. Composés oxygénés du chlore.
La méthode VSEPR (Gillespie) va nous permettre de
déterminer la structure des divers composés oxygénés du chlore. Par exemple,
étudions l'ion chlorate
: le chlore est entouré de 7 + 3 × 2 - 3 × 2 + 1 = 8
électrons, soit 4 paires, dont 3 liantes et un doublet non liant : la structure
des paires liantes est pyramidale à base triangulaire, dérivée de la structure
tétraédrique :
3.3.2. Diagramme de FROST des degrés d'oxydation du chlore.
C’est une méthode graphique qui permet rapidement de prévoir la stabilité de chaque degré d’oxydation, ainsi que de déterminer le potentiel d’électrode de n’importe quel couple rédox de l’élément considéréLe principe du tracé de ce diagramme
est de reporter en ordonnée l’enthalpie libre de formation divisée par la
constante de Faraday ![]() à 298°C de chaque degré d’oxydation en fonction de ce degré
d’oxydation en abscisse.
à 298°C de chaque degré d’oxydation en fonction de ce degré
d’oxydation en abscisse.
C’est beaucoup plus simple que cela
en a l’air. En effet, ![]() correspond à la réaction
correspond à la réaction ![]() , alors que le
potentiel rédox est défini pour la réaction inverse, soit :
, alors que le
potentiel rédox est défini pour la réaction inverse, soit : ![]() , ou encore
, ou encore ![]() , où n
est le degré d’oxydation, mais aussi la différence entre le degré d’oxydation
considéré et le degré zéro (nous verrons que cette façon de voir les choses
pourra nous aider tout à l’heure) ; et
, où n
est le degré d’oxydation, mais aussi la différence entre le degré d’oxydation
considéré et le degré zéro (nous verrons que cette façon de voir les choses
pourra nous aider tout à l’heure) ; et ![]() le potentiel rédox
du couple
le potentiel rédox
du couple ![]() .
.
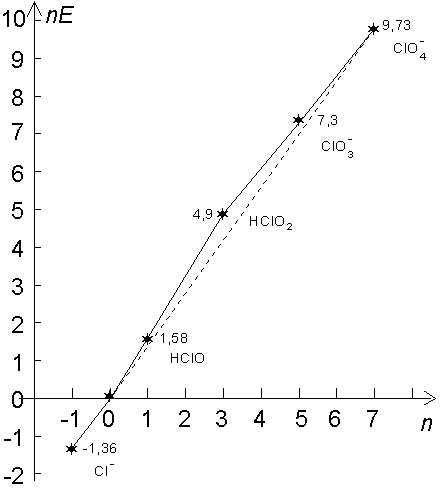 Il suffit donc de tracer (n – 0)×
Il suffit donc de tracer (n – 0)×![]() en fonction de n
.
en fonction de n
.
Prenons l’exemple des divers degrés d’oxydation du chlore :
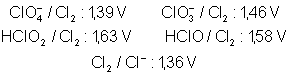
3.3.2.1. Démontrons maintenant que l’on peut déterminer les potentiels rédox de tous les couples possibles grâce à ce diagramme, et inversement, de tracer ce diagramme à partir des autres potentiels rédox.
Soient ![]() et
et ![]() (avec
(avec ![]() >
> ![]() ) les deux
degrés d’oxydation concernés. La réaction correspondant à l’enthalpie libre
définie par
) les deux
degrés d’oxydation concernés. La réaction correspondant à l’enthalpie libre
définie par
![]()
est la suivante :
![]()
Donc ![]() , soit
:
, soit
:
![]()
Or ![]()
Donc ![]()
ou encore
![]()
Appliquons ce résultat à la
détermination du potentiel rédox du couple ![]() :
:
Ainsi ![]()
Admettons d’autre part que nous ne
connaissions pas le potentiel rédox du couple ![]() , donc que l’on ne
puisse pas déterminer le point représentatif de
, donc que l’on ne
puisse pas déterminer le point représentatif de ![]() sur le diagramme.
Par contre, on connaît le potentiel rédox du couple
sur le diagramme.
Par contre, on connaît le potentiel rédox du couple ![]() qui vaut 1,42 V,
ainsi que celui du couple
qui vaut 1,42 V,
ainsi que celui du couple ![]() qui vaut 1,58 V. D’après (I),
qui vaut 1,58 V. D’après (I),
![]()
soit : 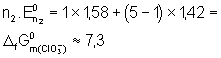
Ce qui est d’ailleurs bien le résultat déjà connu.
On peut donc construire un tel diagramme en connaissant les potentiels rédox quelconques, dans la mesure où chacune des espèces est représentée une fois.
3.3.2.2. Étude de la stabilité des degrés d’oxydation : dismutation et médiamutation.
Montrons maintenant que les degrés d’oxydation, situés au dessus d’une droite reliant deux autres degrés d’oxydation situés de part et d’autre, sont instables et se dismutent (thermodynamiquement).
Prenons l’exemple de l’acide
hypochloreux HClO. Peut-il se dismuter en ion chlorure et ion chlorate ? Il
suffit de calculer l’enthalpie libre de la réaction correspondante : ![]()
Soit ![]() On retrouve les
valeurs des enthalpies libres de formation sur le diagramme de Frost, en
multipliant ces valeurs par F .
On retrouve les
valeurs des enthalpies libres de formation sur le diagramme de Frost, en
multipliant ces valeurs par F .
Donc l'enthalpie de cette réaction de dismutation vaut :
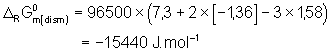
Ce qui est bien négatif. Cette réaction est donc spontanée et l’acide hypochloreux instable.
Étudions maintenant la médiamutation bien connue qui a lieu lorsque l’on mélange HClO et HCl. Il apparaît alors un fort dégagement de chlore :
![]()
De la même manière que précédemment,
l’enthalpie libre de la réaction vaut : 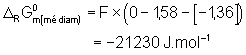
qui est également négative. On peut donc en conclure que le mélange de deux degrés d’oxydations, encadrant un degré d’oxydation dont le point représentatif du diagramme de Frost est situé en dessous de la droite joignant les deux premiers degrés d’oxydation, est un mélange instable qui va subir une médiamutation en donnant le degré d’oxydation intermédiaire.
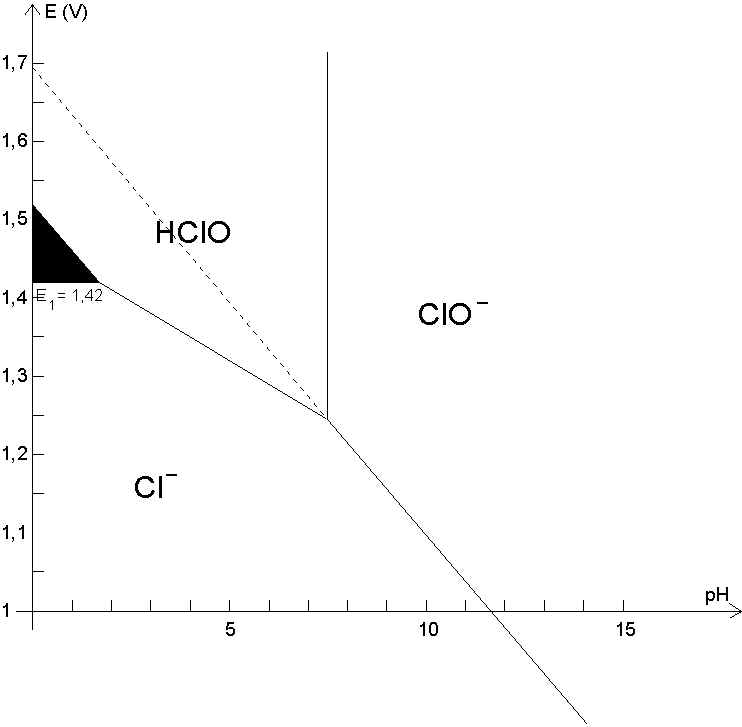
3.4. Diagramme Potentiel - pH du Chlore.
Nous ne tracerons ce diagramme que pour les trois degrés d'oxydation -1 , 0 et +1.
Nous disposons de deux potentiels rédox :
et d'une constante d'acidité :
Il nous faut tracer l'évolution du potentiel d'équilibre entre les formes réduite et oxydante pour une concentration donnée égale pour chacune des formes en solution. Pour cela nous utiliserons l'équation de NERNST :
3.4.1. Couple
L'équation rédox est :
Nous poserons dans toute la suite du problème que
les concentrations des espèces en solution sont égales à .
Au lieu d'utiliser les concentrations des espèces
gazeuse, nous utiliserons leur pression partielle, car, généralement, le
potentiel rédox standard a été déterminé en présence de composés gazeux à la
pression de 1 bar.
La concentration n'a pas non plus beaucoup de sens pour les solides. On utilisera alors leurs activité, qui est égale à 1 si ces solides sont des composés purs. Nous étudierons un problème où le solide est un mélange homogène, et où l'activité du réducteur solide n'est plus égale à 1.
L'équation précédente devient :
3.4.2. Couple .
3.4.3. Couple
Si l'on trace les deux droites précédentes dans un
repère E = f(pH), l'on constate qu'elles se coupe pour :
Au delà de ce pH, il s'agit d'exprimer le
potentiel de passage de , directement.
Nous disposons de deux méthodes.
1) La première consiste à déterminer le potentiel
rédox standard du couple . Pour cela, on va utiliser le diagramme de Frost :
Puis, grâce à Nernst :
Et, en utilisant nos valeurs de concentration :
2) L'autre méthode consiste à supposer inconnu le
potentiel rédox standard du couple . L'équation
précédente est alors :
A cause du principe de continuité, le potentiel des trois couples précédemment étudiés doit être le même pour pH = 0,66.
Or, par exemple, à pH = 1,66
Donc :
3.4.4. Couple .
Au delà de pH = 7,5 , nous avons affaire au couple
. Là
encore, il y deux méthodes qui permettent de déterminer l'équation donnant
l'évolution du pH de ce couple en fonction du pH :
) Nous disposons de deux données thermodynamiques :
Le potentiel rédox normal du couple est donc :
Appliquons l'équation de Nernst :
Il est évident que le coefficient directeur de la
droite vaut 0,06. Déterminons
en admettant la
continuité de
et de
pour pH = 7,5.
Donc C.Q.F.D. Voici le
tracé du diagramme potentiel - pH pour les conditions proposées :
3.5.1. Principe de l'électrolyse.
Pour comprendre l'intérêt des diverses méthodes d'électrolyse, nous utiliserons les diagrammes intensité-potentiel.
a) Électrolyse sur anode de platine et cathode de nickel, du chlorure de sodium fondu.
Les deux couples sont des couples
rapides. Sur le diagramme i/E , leurs courbes ne se coupent pas. Pour que cela
ait lieu, il faut donc porter, par exemple, le couple
à un potentiel bien
plus élevé. C'est ce qui est obtenu en créant entre les deux électrodes une
différence de potentiel plus élevée que celle existant entre les deux couples à
l'équilibre (lorsque le courant ne passe pas). Puisque
et
, il faut donc que
la d.d.p. imposée aux bornes de l'électrolyseur soit supérieure à 4,07 V :
b) Électrolyse du chlorure de sodium dissous dans l'eau, sur anode de platine platiné et cathode identique.
Interviennent également ici les couples de l'eau :
,
;
,
.
Sur le platine platiné, la surtension du couple
vaut
0,37 V. On constate qu'à partir du moment où la d.d.p. imposée entre les
électrodes vaut 1,36 V, l'électrolyse commence car
et
se déchargent avant
les autres ions de même nature. On récupère donc
à la cathode et à
l'anode.
N.B. : La surtension de est négligeable sur
le platine platiné.
Le platine étant trop cher, on utilise souvent une
anode de graphite et une cathode en fer. La surtension de sur le graphite
vaut 1,6 V , celle de
sur le graphite est nulle et celle de
sur le fer vaut
0,09 V. L'électrolyse donne également de l'hydrogène et du chlore, en utilisant
une d.d.p. à peine supérieure :
g) Électrolyse avec cathode de mercure.
On utilise de moins en moins cette méthode à cause
des rejets possibles de mercure dans l'environnement (cf. l'affaire de
Minamata). Cependant elle présente un grand intérêt théorique. La cathode est en
graphite, et donc les surtensions d' et de
sont les
mêmes que dans le cas précédent.
Par contre, la surtension cathodique d' sur Hg
devient : -1,35 V à pH = 0, et la décharge de
donne un amalgame
de sodium. Il faut alors considérer la mise en jeu d'un autre couple rédox :
, de
potentiel E = - 1,7 V. Si l'on travaille à pH = 7, il faut retrancher
au
potentiel du couple
, ce qui signifie que
ne commencera à se
décharger qu'au dessous de -1,77 V. C'est donc la réduction de
en amalgame de sodium qui va se
faire le plus rapidement. Au cours de l'électrolyse, la disparition de
va rendre le pH de plus
en plus basique, et donc favoriser encore plus la formation de l'amalgame.
3.5.2. Applications industrielles.
L'anode est toujours en carbone.
) Cathode en fer
Il existe essentiellement deux types d'électrolyseurs. Le premier présente un agitateur qui met en contact le chlore et la soude se formant à la cathode lors du dégagement d'hydrogène. Il y a donc dismutation du chlore en ions chlorure et hypochlorite : c'est une solution d'eau de Javel :
L'électrolyse à cathode filtrante permet de récupérer séparément le chlore (pour la synthèse des dérivés halogénés) et l'hydrogène (pour la synthèse de l'ammoniac).
) électrolyseur à cathode de mercure.
L'amalgame de mercure est récupéré au bas de l'électrolyseur, et est ensuite détruit dans l'eau à pH neutre, le dégagement de l'hydrogène et l'élimination permanente de la soude formée favorisant la réaction :
4. Réactivité du chlore.
4.1.1. Enthalpie libre de formation. Propriétés physiques.
HCl est très stable, sa réaction de synthèse est très exothermique, voire explosive lorsque le mélange chlore + hydrogène est exposé à la lumière.
Le mécanisme en est le suivant :
L'énergie de liaison est très élevée :
, mais la
polarisation importante de cette liaison ainsi que la très forte énergie de
solvatation de l'ion chlorure et du proton vont favoriser la forte réactivité de
HCl.
Sa température d'ébullition est relativement basse, car les liaisons hydrogène sont assez faibles entre ces molécules (-85°C), alors que le fluorure d'hydrogène est liquide à température ordinaire grâce aux fortes liaisons hydrogène intramoléculaires.
Son moment dipolaire vaut 1,03 D et la longueur de liaison est égale à 0,126 nm. Le calcul donne un pourcentage de caractère ionique égal à 17%.
4.1.2. HCl en solution aqueuse.
L'enthalpie de solvatation des ions est très négative, aussi la dissolution de HCl dans l'eau est-elle exothermique :
Le
du couple acide - base
est égal à -7 : HCl
est un acide fort dans l'eau.
4.1.3. Réactivité de HCl vis à vis des bases de Lewis.
Les bases de Lewis plus fortes que donneront une
réaction totale :
, de même structure que KCl , donc très
stable.
4.2. Réactivité du chlore avec les métaux.
Chaleur de formation des chlorures
On peut tracer un diagramme d'Ellingham pour les
chlorures métalliques. Le chlore réagit avec tous les métaux, même avec le
platine. Voici un tableau donnant les enthalpies de formation de quelques
chlorures métalliques (en ) :
| KCl | |||||||||
| -439 | -401 | -301 | -263 | -238 | -117 | -222 | -192 | -142 | -125 |
| BrCl | AuCl | ||||||||
| -209 | -247 | -184 | -180 | -167 | -46 | +8 | -54 | -33 |
On constate une évolution semblable à celle des
oxydes (diminution de l'enthalpie de formation au fur et à mesure de
l'augmentation du caractère covalent des liaisons), à cette différence près que
les chlorures alcalins (structure NaCl et CsCl) sont cette fois-ci plus stables
que les chlorures alcalino-terrreux (structure fluorine). Les chlorures
divalents plus covalents ont une structure rutile () ou lamellaire
(
).
Enfin, on constate que les halogénures covalents sont en général moins stables que les ioniques. Ceci est valable pour les chlorures métalloïdiques mais aussi pour les chlorures correspondant aux degrés d'oxydation élevés des métaux de transition :
Les structures des halogénures covalents sont
obtenues par la méthode V.S.E.P.R. (Gillespie). Ne pas oublier que est en
fait un composé solide ionique (structure NaCl) formés des ions
et
. Le chlorure
d'aluminium
est covalent.
Les chlorures peuvent servir à la synthèse de certains métaux :
5. Comparaison des différents halogènes.
Voir le tableau en fin de paragraphe
Commentaires :
L'évolution des potentiels d'ionisation est normale : l'énergie des électrons 5p (couche de valence de l'iode) est moins négative que celle des 4p , etc.…
Par contre, la stabilisation d'un électron par
capture (formation de ) devrait être d'autant plus facile qu'il est soumis à un champ
électrique plus fort, ce qui est le cas pour le petit atome de fluor. Mais la
mesure des affinités électroniques montre un maximum pour le chlore. En effet,
les O.A. 3d du chlore interviennent ici pour stabiliser cet électron, beaucoup
mieux que ne l'effectuent les seules O.A. 2p du fluor.
Les divers rayons évoluent en fonction de la taille du cortège électronique de chaque atome.
Les molécules sont purement
covalentes, ainsi que le montrent les températures de changement d'état qui
augmentent avec la masse molaire des molécules. Comme on l'a déjà vu,
l'intervention des O.A. 3d confère à la molécule de
une stabilité
remarquable (maximum des enthalpies de dissociation).
La forte électronégativité du fluor explique
pratiquement toutes les propriétés de HF, et son évolution explique la variation
des quatre propriétés suivantes. Par contre le et la température
d'ébullition du fluor se distinguent par leur excès manifeste : Il faut faire
intervenir ici les liaisons hydrogène que créent entre elles les
molécules de HF. Elles surpassent la force des liaisons de Van der Waals
dont l'existence à elle seule explique les évolutions des mêmes grandeurs de HCl
à HI. Il sera donc beaucoup plus difficile de rompre les liaisons
intramoléculaires de HF ( température d'ébullition anormalement élevée), et les
protons seront piégés par cette liaison H (
élevé). On peut
aussi dire que
est tellement petit qu'il sera, non pas une base très faible
(
,etc.…), mais une base faible.
On constate, comme pour les oxydes, que la stabilité des halogénures diminue :
a) avec l'augmentation du rayon de l'anion pour
les structures ioniques : le rapport s'éloigne beaucoup
de 0,6 , qui confère la meilleure stabilité aux structures NaCl et fluorine.
b) avec l'augmentation du caractère covalent de
l'halogénure: ainsi est-il ionique, alors que les autres halogénures d'aluminium
sont covalents. On retrouve cette évolution pour les températures d'ébullition.
| F | Cl | Br | I | F | Cl | Br | I | ||
| Potentiel d'ionisation eV | 17,42 | 13,01 | 11,84 | 10,45 | Longueur de liaison (nm) | 0,142 | 0,200 | 0,228 | 0,267 |
| Affinité électronique eV | -3,45 | -3,61 | -3,36 | -3,06 | Enthalpie de dissociation (kJ) | 150 | 238 | 190 | 148 |
| Électronégativité (Pauling) | 4,00 | 3,00 | 2,80 | 2,65 | Température d'ébullition (°C) | -190 | -35 | +55 | +190 |
| Rayon
ionique (nm) ( |
0,136 | ,0,180 | 0,194 | 0,215 | Température de fusion (°C) | -220 | -110 | -10 | +110 |
| Rayon covalent | 0,071 | 0,100 | 0,114 | 0,133 | |||||
|
Halogénures d'hydrogène |
Halogénures | ||||||||
| Moment dipolaire (D) | 1,82 | 1,07 | 0,79 | 0,38 | Potentiel d'électrode ( |
+2,87 | +1,36 | +1,07 | +0,54 |
| Longueur de liaison (nm) | 0,092 | 0,180 | 0,194 | 0,215 |
Enthalpie de formation (kJ/mol de Cl) .../... | ||||
| % Caractère ionique partiel | 45 | 17 | 12 | 5 | NaX | -560 | -410 | -351 | |
| Enthalpie de formation (kJ) | -272 | -92 | -50 | +25 | -552 | -326 | -259 | -177 | |
| Énergie de liaison (kJ) | 560 | 426 | 359 | 293 | -496 | -231 | -173 | -106 | |
| 4 | -7 | -9 | -11 | -393 | -167 | -104 | -38 | ||
| Température d'ébullition (°C) | 19,4 | -85 | -67 | -35 | |||||
|
Halogénures |
|||||||||
|
Températures d'ébullition (°C) |
|||||||||
| NaX | 1700 | 1450 | 1400 | 1300 |
halogénures ioniques | ||||
| 2300 | 1400 | 1200 | 900 | ||||||
| 1290 | 180 | 255 | 380 | ||||||
| -60 | 50 | 100 | 250 |
halogénures covalents | |||||
6. Composés oxygènés des halogènes. Composés interhalogènés.
Le chlore est le seul halogène qui possède tous les degrés d'oxydation :
Le brome ne possède pas le degré +III , l'iode ni le degré +IV ni le +VI, ni le +III.
Le fluor donne quelques fluorures d'oxygène
instables (,…)
L'étude des températures d'ébullition
des composés interhalogénés montrent bien une évolution en fonction de la masse
molaire, sauf pour ICl (moment dipolaire très important).
Les fluorures les plus stables sont :