1.1 Modification des niveaux d'énergie des OA d d'un métal sous l'effet d'un champ octaédrique créé par 6 ligands (représentés par 6 charges négatives)
Les OA et
sont
déstabilisées, alors que les OA
,
et
sont relativement
stabilisées. On appelle ce type de distinction une levée de dégénérescence ou
”splitting” :
Voici, proportionnelles à la force du champ électrostatique créé par les ligands, les énergies des divers niveaux ”d” apparaissant dans chaque type d'environnement :
Les orbitales d présentent maintenant des niveaux d'énergie différents. Il semble logique à priori d'appliquer à tous les cas le principe d'énergie croissante. Mais certains ligands créent un champ électrostatique si faible que ce principe n'est pas applicable, et il faut alors appliquer la règle de Hund. On appelle le type normal, un complexe à champ fort, et le second type, un complexe à champ faible.
Prenons l'exemple de l'ion
hexacyanoferrate+II : Lors de la
formation des complexes, les électrons de valence (s et d) se retrouvent tous
dans les orbitales d, quel que soit le degré d'oxydation du métal. Ici, le fer
est au
+2, le nombre d'électrons de valence est donc égal à 6. La
structure du complexe est octaédrique, le splitting est donc celui indiqué en
1.1. :
Comme le remplissage suit la règle de l'énergie
croissante, les 6 électrons se disposent comme indiqué sur la figure ci-dessus.
On constate que la somme des nombres quantiques de spin est nulle. Cet ion est donc
diamagnétique. On dit qu'il est à spin faible. On constate d'autre part que cet
ion métallique, pour pouvoir créer 6 liaisons avec les 6 ligands, doit pouvoir
fournir 6 OA vides (il s'agit ici de liaisons de type ”datives”).
Fe+II pourra utiliser à cet effet 2 OA 3d , 1 OA 4s et 3 OA 4p ,
qu'il va hybrider pour obtenir 6 OA équivalentes ”
”. On démontre ici
la réalité de cette hybridation pour les composés octaédriques.
L'exemple typique en est . L'ion
Fe+III possède 5 électrons de valence qui vont se répartir dans les 5
OA d selon la règle de Hund, malgré l'existence d'un faible ”splitting” :
On constate ici que la somme des nombres
quantiques de spin est égale à + 2,5. On dit qu'il est à spin fort, car il est
fortement paramagnétique. Il faut remarquer que les complexes à champ fort sont
à spin faible, et que ceux à champ faible sont à spin fort. Pour créer 6
liaisons avec les ligands H2O , l'ion Fe+III va utiliser les OA
suivantes : 1 OA 4s, 3 OA 4p et 2 OA 4d (hybridation ) .
Le fer est au zéro. Il possède
donc 8 électrons de valence. Comme le monoxyde de carbone est un ligand à champ
fort le spin minimum est obtenu lorsque 4 OA sont remplies totalement, tout en
respectant le principe d'énergie croissante. Une seule structure permettant 5
liaisons présente cette propriété : la structure bipyramidale trigonale. On
vérifie que les 5 OA hybrides permettant les liaisons avec les ligands sont :
l'OA 3
, l'OA 4s et les 3 OA 4p (
).
Le Nickel, au +2 , comporte 8 électrons de
valence. Le premier ligand crée un champ faible, le second un champ fort.
Considérons les remplissages et les énergies totales dans les deux cas pour les
structures tétraédrique et plan-carré.
Mais la valeur de -14,56 0 ne doit pas faire
illusion : comme on applique ici la règle de Hund, la configuration est
possible, ce qui donne à la structure une énergie de
+ 10,28 0 , nettement plus élevée que les +5,34
0 obtenus pour la valeur maximale de l'énergie pour la structure
tétraédrique. C'est pourquoi
est tétraédrique, et
plan-carré (et
diamagnétique).
Tous deux sont octaédriques et à champ fort. Le remplissage est le suivant : (7 électrons de valence pour Co+II et 6 électrons de valence pour Co+III)
Comme la différence d'énergie entre d' et d" est
grande, il sera facile à de perdre un électron pour donner
, (d'où un
potentiel rédox de 0,36V) alors que
perdra
difficilement un électron pour donner
(d'où le
potentiel rédox de 1,80V)
Considérons la série de composés octaédriques ,
,
. Le
premier absorbe vers 800 nm, il est bleu pâle ; le second absorbe vers 600 nm
(dans l'orange), il est bleu foncé ; le troisième absorbe dans l'UV, il est
incolore. On peut montrer que cette absorption est liée à la transition d'un
électron d'une OA d' à une OA d".
Cette transition est possible dans les trois cas,
seule la différence d'énergie entre ces OA diffère : elle est très forte pour
,
très faible pour
. Comme
, on comprend que le premier absorbe pour de faibles
longueurs d'onde, le second pour des valeurs bien plus élevées.
L'étude, pour un même métal, de divers ligands,
permet de les classer en fonction de la valeur du champ créé par eux sur le
métal. On appelle cette classification la ”série spectrochimique”, où et CO
sont les ligands les plus ”forts”, etc. La limite entre ligands à champ fort et
à champ faible se situe aux environs de NH3 . Tantôt celui-ci est à
champ fort (avec Co), tantôt à champ faible (avec Cu)
Série spectrochimique : (ordre de force décroissant)
![]()
3.2. Isomérie dans les complexes.
3.2.1. Isomérie d'ionisation.
Expérimentalement, il existe deux sortes de
composés de formule brute , l'un, rouge, qui réagit avec AgNO3 pour
donner un précipité de AgBr, l'autre, violet, qui réagit avec AgNO3
pour donner un précipité de Ag2SO4 .
Le premier est le bromure de
pentaammino-sulfato-cobalt+III , ou ; le second est
le sulfate de bromo-pentaammino-cobalt+III ou
Autres isomères remarquables : vert sombre et
violet.
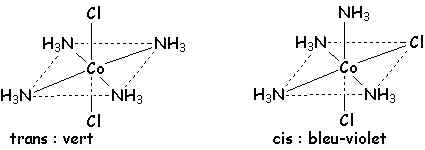
Le diammino-dichloro-platine+II existe sous la forme de deux isomères plan-carré :
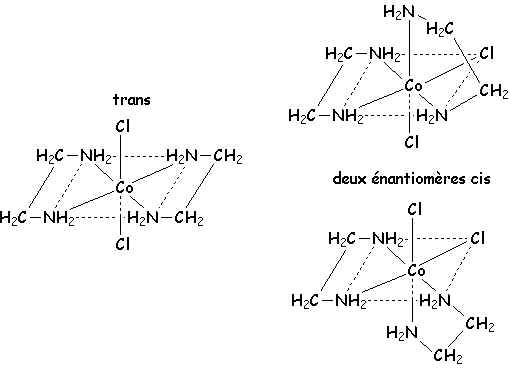
Même chose pour l'ion dichloro-tétraammino-cobalt+III :
Cette isomérie existe aussi avec des ligands
bidendates (tels que l'éthylène diamine , ou l'ion
aminoéthanoate
Par exemple il existe deux isomères de diamino-acétato-platine+II :
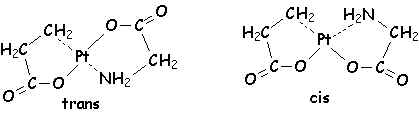
L'ion dichloro-diéthylènediamino-cobalt+III présente deux isomères géométriques trans et cis, le dernier pouvant être dédoublé en deux énantiomères :