
1.Quel est l’acide le plus fort parmi chacune des paires d’acides suivantes :
1.1. 2-chloropropanoïque et dichloro éthanoïque
1.2. benzoïque et 3-chlorobenzoïque
1.3. 
2. Classer les composés suivants dans l’ordre croissant de leur réactivité vis à vis de l’éthanol. Expliquer pourquoi.
Éthanoate de méthyle, chlorure d’éthanoyle , N,N-diméthyl éthanamide, N,N-diméthyl benzamide
3.Un composé A de formule C11H14O2 est soluble à chaud en milieu basique où il réagit pour donner, après extraction de la solution aqueuse, un composé B C7H8O . Le spectre RMN de B présente 3 singulets à 3,7 ; 4,4 et 7,2 ppm, d’intégrations respectives 1,2 et 5 . Quand on laisse B au reflux d’une solution aqueuse de KMnO4 , on isole un autre composé C. Celui-ci, de formule C7H6O2 , montre en IR de fortes bandes à 1690 et 2800-3300 cm–1 (large).
Quand on acidifie la solution basique initiale à partir de laquelle B a été extrait, on peut isoler par extraction un composé D nauséabond de formule C4H8O2 . Son specte RMN montre un singulet à 11 ppm (1p), un doublet à 1,1 ppm (6p) et un heptuplet à 2,4 ppm (1p).
Quelles sont les stuctures de A , B et D ?
4. En utilisant l’acide diphénylacétique, décrire une synthèse du diphénylcétène. Donner le produit de la réaction du diphénylcétène avec :
l’eau , l’aniline , le benzophénol , le méthanol , l’acide diphénylacétique.
5.Donner les produits obtenus dans les réactions suivantes :
5.1. 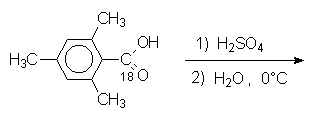
5.2. 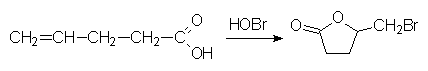 (indiquer uniquement le mécanisme de cette réaction)
(indiquer uniquement le mécanisme de cette réaction)
5.3. 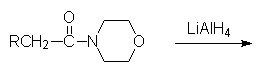
5.4.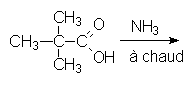 5.5.
5.5. 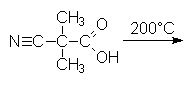
5.6 ![]()
6. Indiquer le produit de la réaction du bromure de phénylmagnésium en excès avec les composés suivants :
6.1. benzoate de phényle 6.2. acétate de phényle
6.3. benzonitrile
6.4. 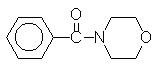
7. 430 mg d’un monoacide A (contenant 7 % d’hydrogène) sont exactement neutralisés par 50 cm3 d’une solution de soude décimolaire. A fixe le brome mole à mole et présente l’isomérie géométrique. Formule de A ?
8. Un composé A, ne contenant que du carbone, de l’hydrogène et de l’oxygène, est insoluble en milieu basique aqueux, mais donne un nouveau composé B, quand on le chauffe en milieu basique. B est également insoluble en milieu basique aqueux ; il a pour formule C5H12O2 et son spectre R M N est donné ci-dessous.
Spectre RMN à insérer
Quand on acidifie la solution basique, on peut, par filtration de la solution, isoler un nouveau composé cristallisé C, de formule C7H6O2. Le spectre I R de C est donné ci-dessous.
Quelles sont les structures de A , B et C ?
9. Compléter les réactions suivantes :
9.1. Acide 2-méthylbutanoïque + Br2 (P catalyseur) ®
9.2. Ion (S,S)-3-chloro-2-méthyl-3-phényl propanoate soumis à la chaleur.
9.3. Stéarate d’argent + Br2 ®
9.4. Benzoate d’éthyle +
acétate d’éthyle ![]()
9.5. Benzoate d’éthyle +
acétate d’éthyle ![]()
10. Décrire les synthèses des composés suivants à partir des produits de départ appropriés et de benzène, de toluène, d’ester malonique, d’ester acétylacétique ou de tout autre composé ayant 4 atomes de carbone au plus .
10.1 3-éthylpentan-2-one (sans utiliser l’ester écétylacétique)
10.2. 2-méthylpent-2-ène-4-one
10.3. 1-acétoxy-3,3-diméthylbutane
10.4. 2,4-diphénylbutan-3-one-oate d’éthyle
10.5. butyl diméthylamine ( à partir de l’acide butanoïque).
11. SYNTHÈSE DE L’ŒSTRONE
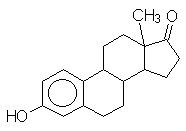
11.1. L’anisole est traité par l’anhydride glutarique en présence de AlCl3. On obtient un composé unique A : C12H14O4 . En donner la formule développée, expliquer le mécanisme de la réaction et donner les raisons pour lesquelles les deux groupes se placent en para. Le composé A est traité par l’éthanol en milieu acide, il en résulte l’ester correspondant. Indiquer le mécanisme de l’estérification. Cet ester est soumis à l’action du succinate d’éthyle en présence de tertiobutylate de potassium. On obtient le composé B qui présente en tout, un cycle de g -lactone, deux fonctions ester, un noyau phényle et un groupe méthoxy. Donner le nom de la condensation mise en jeu et expliquer la formation du cycle g -lactonique.
11.2. B est d’abord traité par la soude, puis par HCl. Montrer que l’on obtient un triacide éthylénique. Préciser la place de la double liaison et dire pourquoi la réaction d’élimination est facile en milieu acide. Le triacide C est d’abord hydrogéné sélectivement en ce qui concerne la double liaison, et transformé en ester méthylique : D . Quelles techniques préconisez-vous pour la réalisation de ces deux transformations ?
11.3. Le triester D ainsi obtenu, est traité par le méthylate de sodium, le carbanion intermédiaire est formé préférentiellement sur le carbone le moins encombré, et l’on obtient ainsi un composé E, ayant deux cycles dont un aromatique, deux fonctions ester et un carbonyle. Donner la formule de E et dire quelle condensation a été réalisée ici ?
11.4. E est traité par l’iodure de méthyle sans que l’on ait quitté le milieu méthylate : montrer que la méthylation se fait en un seul endroit. Le composé formé est opposé au bromoacétate d’éthyle en présence de zinc (Réformatsky). On a à nouveau un triester hydroxylé. En milieu acide formique, ce composé se déshydrate. Montrer que là encore, la déshydratation est univoque. Formule du composé F obtenu ?
11.5. L’action de la soude diluée hydrolyse sélectivement la moins encombrée des trois fonctions ester. Le composé G ainsi obtenu est soumis à l’action du chlorure de thionyle, puis du chlorure d’aluminium. L’hydrogénolyse de la fonction cétone et la réduction de la double liaison conduisent au composé H de formule brute C22H30O5.
11.6. Le composé H obtenu est soumis à l’action de la soude diluée. La fonction ester la moins encombrée est hydrolysée. Puis on fait agir le chlorure de thionyle pour former I . Celui-ci réagit successivement sur le diazométhane, puis sur l’oxyde d’argent, en présence de méthanol. Il se forme J . Donner les mécanismes des réactions permettant de passser de I à J. Sous l’action du méthylate de sodium, J forme un cétoester K qui est hydrolysé, décarboxylé et soumis à l’action de HI. On obtient l’oestrone.