
1. Nommer les composés suivants :

2. Indiquer l’orientation de l’addition de HBr sur les composés suivants :

3. Sans tenir compte de l’isomérie Z/E , il existe treize isomères de formule C6H12 (hexènes) .
3.1. Écrire et nommer chacun d’eux.
3.2. Quatre d’entre eux possèdent des isomères Z/E ; écrire les différentes structures.
3.3. Un de ces alcènes comporte un carbone asymétrique ; lequel ?
4. Classer par ordre d’acidité croissante les corps suivants :
propène, eau, méthylamine, 2–méthyl–propan–2–ol, propyne .
5. En utilisant la nomenclature E/Z , nommer les composés suivants :

6. Pourquoi utilise-t-on des halogénures d’hydrogène gazeux au lieu de leur solution aqueuse lors de la préparation d’halogénures d’alkyle à partir d’alcènes ?
5. Classer les alcènes suivants par ordre de réactivité croissante lors de l’addition de HBr:
éthène, propène, but-2-ène, 2-méthyl-propène
7. Pourquoi obtient-on, lors de l’addition de HBr au 3–méthyl–but–1–ène , à côté du produit attendu, du 2–bromo– 2–méthyl–butane ?
8. Déduisez la structure des alcènes suivants :
8.1. C10H20 par ozonolyse réductrice donne uniquement la pentanone–2.
8.2. C8H14 par la même réaction donne le diméthyl–2,5–hexanedial.
8.3. C8H12 par la même réaction donne 2 moles de butanedial .
9. Expliquer la stabilité extraordinaire du radical allyle CH2 – CH = CH2
Indiquer aussi l’hybridation et la valeur des angles pour les entités suivantes :
![]()
![]()
10. Classer par ordre de stabilité croissante les cations suivants :
10.1. diphénylméthyle 10.2. diméthylméthyle
10.3. éthènyle 10.4. propène-2 yle
10.5. éthyle 10.6 phénylméthyle
10.7. paraméthoxyphénylméthyle
11. Le limonène a pour formule :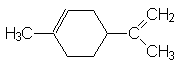
Combien existe-t-il de stéréoisomères ?
Marquer chaque carbone asymétrique.
L’hydrogénation totale conduit à C10H20 . Écrire la formule de ce produit et désigner les carbones asymétriques. Combien existe-t-il d’isomères pour le produit saturé et combien sont-ils doués d’activité optique ?
12. Expliquer pourquoi la configuration s-cis d’un diène conjugué est moins stable que la configuration s-trans .
13. Donner la stéréochimie des produits obtenus par réaction du cyclopentène avec chacun des réactifs suivants :
13.1. H2 , Ni Raney 13.2. Br2 13.3. HBr 13.4. H2SO4 13.5. Br2, H2O
13.6. HOCl 13.7. ICl 13.8. a)B2H6 ; b)![]() 13.9.a)B2H6 ; b)
13.9.a)B2H6 ; b)![]()
14. Représenter en Fischer et en Newman le composé obtenu par addition électrophile de HBr sur l’acide 2-méthyl but-2-ènoïque (E) . Le nommer dans la nomenclature like – unlike – méso . Donner la configuration absolue des carbones asymétriques.
15. Donner le mécanisme de l’isomérisation suivante et en
expliquer la raison.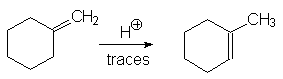
16. Donner des mécanismes en accord avec le fait que les additions de HBr au propènoate d’éthyle donnent le même produit qu’elles soient ioniques ou radicalaires.
17. Donner le mécanisme des réactions suivantes :
17.1. oct-1-ène + bromotrichlorométhane ¾ ® 1,1,1-trichloro-3-bromo-nonane
17.2. hept-1-ène + thiophénol ¾ ® sulfure de heptyle et de phényle
18. Quels sont les alcènes qui donnent, avec les réactifs indiqués, les produits désignés ci-dessous.
18.1. Diborane, puis peroxyde d’hydrogène en milieu basique, pour donner le 3-méthyl -butan -1-ol.
18.2. HBr + peroxyde pour donner le 1,2-dibromo-propane.
18.3. Br2 pour donner le d,l-1,2 dibromo-cyclopropane.
18.4. Tribromométhane
et tertiobutylate
de potassium ![]() pour donner le
trans-2,3-diméthyl-1,1-dibromo-cyclopropane racémique.
pour donner le
trans-2,3-diméthyl-1,1-dibromo-cyclopropane racémique.
18.5. Diiodométhane en présence de zinc et de cuivre pour donner le bicyclo [3,0,1] hexan-3-ol
18.6. Tétroxyde d’osmium, puis sulfure d’hydrogène, pour donner le méso butane-2,3-diol.
19. Donner les structures des diènes et philodiènes qui donnent les produits suivants par réaction de Diels-Alder.

20. Comment distinguer en RMN le cyclohexène, l’hex-1-ène et l’hex-1-yne.
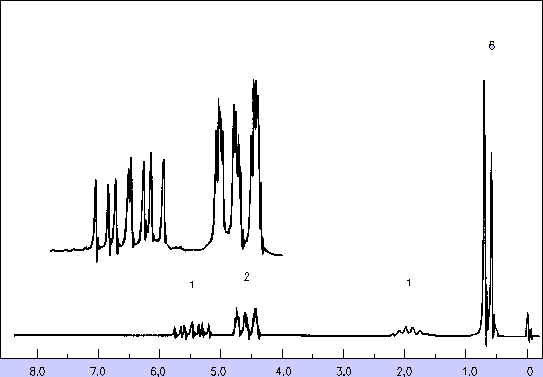
21. Voici le spectre RMN d’un composé C5H10 . Quelle est sa structure, que vous justifierez ?
22. Un composé inconnu a pour formule brute C10H16 . Il absorbe deux moles d’hydrogène par hydrogénation catalytique. Il donne deux monochlorures C10H17Cl par réaction avec une mole de HCl. Il ne réagit pas avec l’anhydride maléique . L’ozonolyse suivie d’un traitement par Zn & HOAc donne de la propanone et du 5-méthyl-2-oxo-hexanedial. Quelle est la structure de cet hydrocarbure et pourquoi ne réagit-il pas avec l’anhydride maléique ?
N.B.: oxo indique la présence d’un groupement carbonyle à la place d’un CH2