1. Calculer l’énergie des photons
associés aux ondes électromagnétiques suivantes :
Onde radio (l =
500 m) ; IR (100 mm) ;
rayonnement visible (500 nm) ; UV (100 nm) ; rayonnement X (0,15 nm)
2. Quelle est la précision maximum de la valeur de la quantité de
mouvement d’un électron dont la position est déterminée à 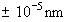 ?
Yaura-t-il des problèmes si la valeur de la quantité de mouvement est
?
Yaura-t-il des problèmes si la valeur de la quantité de mouvement est 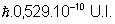
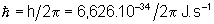
3. La série des raies de Balmer dans le spectre de l’hydrogène
correspond à n1 = 2 dans la relation de Ritz. Calculer l pour
les 6 premières raies de la série.
4. L’énergie d’ionisation de l’atome d’hydrogène,
à partir de son état fondamental, est de 13,6 eV,
4.1. Quelle est la radiation de plus courte longueur d’onde que
peut émettre l’atome d’hydrogène ?
4.2. Donner l’expression de l’énergie caractérisant les
différents états énergétiques de l’atome d’hydrogène en fonction du nombre
quantique principal n. Calculer l’énergie du niveau caractérisé par n =
4.
Quelle est la longueur d’onde des radiations qui peuvent être émises lorsque
l’atome se désexcite à partir de ce niveau ?
5. Comparer les spectres d’émission de l’hydrogène et du
deutérium 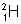 , sachant que
, sachant que 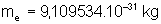 ,
, 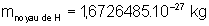 et
et 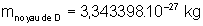
6. Calculer l’énergie d’ionisation (en eV) pour l’atome
d’hydrogène à l’état fondamental, grâce aux données suivantes :
Ry = 10967776 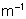 ; h = 6,626.
; h = 6,626.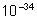 J.s ; c = 3.
J.s ; c = 3.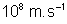 ;
; 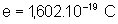 .
.
7. État excité 3d
On considère l’atome d’hydrogène dans l’état
excité 3d.
Quelles sont les transitions d’émission possibles ? Les
représenter sur un schéma.
Calculer les longueurs d’onde des photons correspondant à ces
transitions.
Quelle est l’énergie d’ionisation de l’atome
d’hydrogène dans cet état excité (en eV et en kJ. Mol–1) ?
Données : Énergies propres de l’atome d’hydrogène :
En= – 13,6 / n2
(eV), (n
entier > 0).
4) Ritz constata que certaines des fréquences correspondantes se
déduisent des autres par combinaison linéaires. Vérifier cette relation.
8. Vrai ou faux ?
Identifier les propositions fausses et les rectifier. (O.A. = orbitales
atomiques)
8.1. L’énergie de l’électron dans l’atome
d’hydrogène ne dépend que du nombre quantique principal n.
8.2. Les O.A. de type s ont la symétrie sphérique.
8.3. Une surface nodale est une surface sur laquelle la fonction
d’onde est minimale.
8.4. Les O.A. 2px, 2py et 2pz sont de
révolution autour des axes de coordonnées.
8.5. He2+ est un ion hydrogénoïde.
8.6. Dans Li2+, l’énergie des orbitales atomiques ne
dépend que du nombre quantique principal n.
8.7. Un atome excité est un atome qui a perdu un électron.
8.8. Le rayon des orbitales atomiques diminue lorsque le nombre
quantique principal augmente.
8.9. L’O.A. y4,1,0
a la symétrie sphérique.
8.10. Les O.A. 3dxy, 3dyz et 3dzx sont
de révolution autour des axes de coordonnées.
8.11. L’O.A. y4,3,3
est une O.A. de type f.
8.12. En émettant un photon (une onde électromagnétique), un atome
retourne toujours à l’état fondamental.
8.13. L’énergie d’ionisation de He+ est quatre
fois plus grande que celle de l’atome d’hydrogène.
8bis. Ion hydrogénoïde
1) Rappeler la définition d’un ion hydrogénoïde
2) Les valeurs de l’énergie propre de ces systèmes satisfont à
la relation : En= – Ei / n2 où n est
un entier strictement positif. Que représente Ei ?
3) Les ions Be+ et Li2+ sont-ils des systèmes
hydrogénoïdes ?
4) Les énergies d’ionisation de He+ et Li2+
sont respectivement 54,4 eV et 122 eV. Peut-on trouver une relation simple entre leur
nombre de charges, leur énergie d’ionisation et celle de l’atome
d’hydrogène ?
5) Calculer la valeur de l’énergie propre des quatre premiers
niveaux de ces atomes. Les comparer à ceux de l’atome d’hydrogène. Pourquoi
peut-on dire que l’électron devient de plus en plus lié à mesure que Z augmente ?
9. Désexcitation
1) Des atomes d’hydrogène initialement à l’état
fondamental, sont excités par un rayonnement U.V. de longueur d’onde 97,35 nm. Quel
est le nombre quantique principal de l’état ainsi obtenu ?
2) Quelles sont les longueurs d’onde des différentes radiations
que peuvent émettre les atomes lorsqu’ils se désexcitent ?
10. Principe de Pauli
Parmi les configurations électroniques suivantes, quelles sont celles
qui ne respectent pas le principe d’exclusion de Pauli ?
Que peut-on dire des atomes correspondants ?
1s32s22p6
1s22s22p5
1s22s22p43s13p1
1s22s22p63s23p63d104s2
1s22s22p63s23p63d144s2
11. Principe de construction
1) Établir la configuration électronique de l’atome de fluor (Z
= 9) à l’état fondamental.
2) Soit un atome de fluor de formule électronique 1s22s22p43s1
; comparer qualitativement son énergie à celle de l’atome de fluor à
l’état fondamental.
12. Règles d’établissement de la configuration électronique
On propose différentes configurations électroniques pour l’atome
de nickel (Z = 28) :
1s22s22p63s23p63d104s0 ;
1s22s22p63s23p83d64s2 ;
1s22s22p63s23p63d84s2 ;
1s22s22p63s23p63d64s24p2 ;
Parmi ces configurations :
1) Quelle est celle qui ne respecte pas le principe de Pauli ?
2) Quelle est celle qui représente l’atome de nickel à
l’état fondamental ? Préciser, si nécessaire, le nombre d’électrons
célibataires.
3) Quelle est celle qui ne comporte aucun électron célibataire ?
4) Classer, par ordre d’énergie croissante, les différentes
configurations.
13. Détermination de la configuration électronique
Déterminer la configuration électronique des atomes ou ions suivants
dans leur état fondamental :
O (Z= 8) ; Al3+(Z = 13) ; Cl–(Z= 17) ; K (Z=
19) ; Fe (Z = 26) ; Hg (Z = 80).
14. Utilisation de la représentation de Lewis
L’atome d’un élément, X, à identifier a pour
représentation de Lewis dans l’état fondamental : 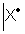
1) Combien d’électrons de valence possède-t-il ?
2) Sachant que leur nombre quantique principal est 2, déterminer le
numéro atomique de X et établir la configuration électronique complète de son
atome.
3) Identifier X par son nom et son symbole.
15. Noble cœur et configuration électronique
1) Établir la configuration électronique de l’atome de calcium
(Z = 20) dans l’état fondamental.
2) Représenter cette configuration à l’aide du
cœur correspondant
à un gaz noble.
16. Utilisation de la représentation de Lewis
L’atome d’un élément, Y,
à identifier a pour
représentation de Lewis dans l’état fondamental : 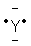
1) Combien d’électrons de valence possède-t-il ?
2) Sachant que leur nombre quantique principal est 3, déterminer le
numéro atomique de X et établir la configuration électronique complète de son
atome.
3) Identifier Y par son nom et son symbole.
17. Détermination de la représentation de Lewis
1) Déterminer la configuration électronique des atomes ou ions
suivants dans leur état fondamental :
S2– (Z= 16) ; Ca (Z=20) ; Be (Z=4) ; Na+ (Z
= l l) ; Cu (Z = 29)
2) En déduire la représentation de Lewis correspondante.
18. Vrai ou faux !
Parmi les propositions suivantes, déterminer celles qui sont erronées
et les rectifier.
Dans un atome polyélectronique, la charge effective ressentie par un
électron est toujours inférieure à la charge du noyau
L’effet d’écran ressenti par un électron est le même pour
tous les électrons de l’atome.
19. Configuration électronique et Tableau périodique
Les réponses aux questions sont à donner sans consulter le Tableau
Périodique.
1) Trouver la configuration électronique des éléments suivants :
a) un chalcogène de numéro Z inférieur à 20.
b) un halogène, de même période que le potassium (Z = 19 ).
Classer, en fonction de leur configuration électronique, les espèces
chimiques
4
Be, 4Be2+, 6C, 6C2+,
6C4+, 8O, 9F, 9F– ,
11Na, 11Na+, 12Mg, 15P, 15P3+,
15P5+, 16S, 16S2+, 17Cl,
17Cl–, 17Cl+, 17Cl3+,
22Ti, 22Ti2+, 22Ti4+, 23V,
24Cr, 24Cr4+, 26Fe2+, 26Fe3+
par périodes, par blocs et par familles.
3) Déduire le numéro atomique et la configuration électronique des
éléments suivants :
a) le deuxième halogène,
b) le troisième métal de transition
d,
c) le quatrième alcalin, d) le cinquième gaz noble.
20. Montrer la distribution électronique dans les orbitales atomiques
du carbone.
![]() ?
Yaura-t-il des problèmes si la valeur de la quantité de mouvement est
?
Yaura-t-il des problèmes si la valeur de la quantité de mouvement est ![]()
![]()
![]() , sachant que
, sachant que ![]() ,
, ![]() et
et ![]()