La formule brute est donc
La masse moléculaire (ou molaire) est calculée à partir de la masse d’un échantillon de gaz dans les conditions normales de température et de pression en utilisant la loi des gaz parfaits.
|
Analyse Élémentaire Organique |
1. Rappel des notions d’atome-gramme et de mole.
– un atome gramme d’un élément simple
représente N = 6,02.1023 atomes de cet élément simple. On dit que sa masse
atomique (A) est égale à la masse de N atomes.
– une mole est une quantité de matière qui représente N = 6,02.1023
molécules de la substance considérée.
Ainsi la masse molaire du butane C4H10 vaut-elle 58 g
Exercice n°1 (généralités).
2. Détermination de la formule brute d’un composé.
Exercice n°2 (généralités).
Puisque la somme des pourcentages de C et de H est égale à 100,01%, il n’y a aucun autre élément présent dans ce composé. La formule empirique d’un composé est formée du plus petit rapport de nombres entiers représentant chaque sorte d’atomes présents. On obtient ces nombres entiers à partir des pourcentages qui correspondent aux masses de chaque atome dans 100 g de composé, en les divisant chacun par la masse atomique. Ainsi
Élément |
Masse de l’élément dans 100 g de composé |
Masse atomique |
Nombre relatif d’atomes |
C |
84,41 |
12,01 |
7,028 |
H |
15,60 |
1,008 |
15,48 |
Si l’on divise chaque quotient par le plus petit, on obtient le plus petit rapport : C = 1,000 H = 2,203
Puisque le rapport H / C n’est pas un nombre entier, on multiplie ces deux nombres par un nombre entier pour obtenir des valeurs entière
´ 1 |
´ 2 |
´ 3 |
´ 4 |
´ 5 |
´ 6 |
|
C |
1,000 |
2,000 |
3,000 |
4,000 |
5,000 |
6,000 |
H |
2,203 |
4,406 |
6,609 |
8,812 |
11,015 |
13,218 |
Le multiplicateur qui fournit deux nombres presque entiers
est 5.
La formule brute est donc ![]() avec
avec ![]()
La masse moléculaire (ou molaire) est calculée à partir de la masse d’un
échantillon de gaz dans les conditions normales de température et de pression en
utilisant la loi des gaz parfaits.
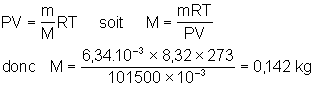
Donc M = 142 g . Dans la formule précédente, n = 2 et la formule correcte est C10H22
Exercice n°3 : Rép : C6H14
3. Détermination des masses molaires.
Elle peut se faire de diverses manières. Nous envisagerons deux méthodes physiques et une méthode spectroscopique.
3.1. Cryoscopie. Ébulliométrie.
Cette méthode utilise la loi empirique de RAOULT :
![]() où
où ![]() est la molalité ou nombre de moles par kilogramme de solvant. Kf
est la constante de RAOULT liée à la fusion du solvant.
est la molalité ou nombre de moles par kilogramme de solvant. Kf
est la constante de RAOULT liée à la fusion du solvant.
Exercice n°4 Rép : M = 369 g
3.2. Pression osmotique.
On détermine la différence des pressions existant de part et d’autre d’une membrane poreuse, avec d’un côté un solvant pur, et de l’autre, le même solvant contenant le soluté de concentration molaire C. On appelle cette différence la pression osmotique P : P = C.R.T
où P est exprimé en Pascals et C en mol.m–3
Exercice n°5 Rép : M = 240.103 g
3.3. Spectrographie de masse.
Notions fondamentales
1. Électronégativité des éléments.
Définition de PAULING : c’est le pouvoir d’un atome d’attirer à lui les électrons.
Cette propriété entraîne la polarisation des liaisons, ce qui régit le sens des réactions.
Pauling a établi une échelle de valeurs numériques des électronégativités des éléments à partir des énergies de liaison (entre 0,8 et 4). Mulliken a donné une autre échelle.
H 2,2 |
Échelle d’Électronégativité selon Pauling |
He | |||||||||||||||
Li 1,0 |
Be 1,6 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
Ne | ||||||||||
Na 0,9 |
Mg 1,3 |
Al 1,6 |
Si 1,9 |
P 2,2 |
S 2,6 |
Cl 3,1 |
Ar | ||||||||||
K 0,8 |
Ca 1,0 |
Sc 1,4 |
Ti 1,5 |
V 1,6 |
Cr 1,7 |
Mn 1,5 |
Fe 1,8 |
Co 1,9 |
Ni 1,9 |
Cu 2,0 |
Zn 1,7 |
Ga 1,8 |
Ge 2,0 |
As 2,2 |
Se 2,5 |
Br 2,9 |
Kr |
Rb 0,8 |
Sr 1,0 |
Y 1,2 |
Zr 1,3 |
Nb 1,6 |
Mo 2,1 |
Tc 1,9 |
Ru 2,2 |
Rh 2,3 |
Pd 2,2 |
Ag 1,9 |
Cd 1,7 |
In 1,8 |
Sn 1,9 |
Sb 2,1 |
Te 2,2 |
I 2,7 |
Xe |
Cs 0,7 |
Ba 0,9 |
La 1,1 |
Hf 1,3 |
Ta 1,5 |
W 2,4 |
Re 1,9 |
Os 2,2 |
Ir 2,2 |
Pt 2,3 |
Au 2,5 |
Hg 2,0 |
Tl 2,0 |
Pb 1,9 |
Bi 2,0 |
Po 2,0 |
At 2,2 |
Rn |
2. Types de liaisons.
Les structures organiques présentent de nombreux types de liaison.
2.1. Liaisons ioniques.
Appelée hétéropolaire également.
Résulte du transfert d’un ou plusieurs électrons périphériques d’un
élément électropositif sur la couche externe d’un élément électronégatif :
![]()
![]() a la configuration du
néon. Cl– a celle de l’argon.
a la configuration du
néon. Cl– a celle de l’argon.
On rencontre les liaisons ioniques dans les sels d’acide carboxylique et les sels d’ammonium par exemple :
acétate de sodium CH3 — CO — O–,
Na+ chlorure de tétraméthylammonium ![]()
2.2. Liaisons covalentes.
Résultent de la mise en commun de deux électrons ; chaque atome participe à la liaison en fournissant un électron. Le doublet de liaison appartient à la couronne électronique de chaque atome uni par la liaison.
exemple : ![]()
Cette liaison est appelée liaison s (voir cours d’atomistique)
Elle est rigide. Par exemple CH3Br + CH3CH2Cl ¹ CH3Cl + CH3CH2Br , alors qu’une solution équimolaire de sels ioniques tels que KCl + NaBr est identique à une solution de KBr + NaCl .
Cette rigidité impose la notion d’isomérie (de position, la plus simple, mais aussi géométrique ou optique). Par exemple: C3H7Cl
CH3CH2CH3Cl CH3CHClCH3 1-chloropropane 2-chloropropane
teb +46°C +36,5°C
Lorsque les deux atomes liés sont différents, le doublet de liaison n’est plus à mi-chemin des deux atomes. Les électrons vont vers l’atome le plus électronégatif : la liaison est polarisée.
CH3 — CH3 CH3 –® – Cl CH3 –¬ – Li éthane chlorométhane méthyllithium
2.3. Liaisons multiples.
Deux électrons supplémentaires peuvent être mis en commun : on obtient une double liaison. Exemple, l’éthène : H2C = CH2
Cette liaison supplémentaire est de nature différente et s’appelle liaison p . Elle est plus sensible aux sollicitations extérieures.
Il existe des doubles liaisons entre C et des hétéroatomes : C = O C = N – C=S
Comme O et N sont plus électronégatifs que C , la seconde
liaison est fortement polarisée : ![]()
Il existe aussi des enchaînements résultant de la mise en commun de 6 électrons, la 3ème liaison est de même nature que la 2ème.
exemples : les acétyléniques — C º º C — , les nitriles — C º º N .
2.4. Les doublets libres.
Tous les électrons de la couche périphérique (électrons de valence) ne sont pas impliqués dans les liaisons contractées par l’atome qui les contient. Les doublets électroniques disponibles sont appelés doublets « n ». Ils sont d’autant plus disponibles (donc réactifs) que l’atome est moins électronégatif :
![]() ordre de réactivité décroissant
ordre de réactivité décroissant
2.5. Liaisons coordinatives (ou semi-polaires).
Mise en commun d’un doublet aux dépends d’un seul atome, l’élément donneur, l’autre étant l’accepteur. Celui-ci devient plus riche en électrons, l’autre plus pauvre.
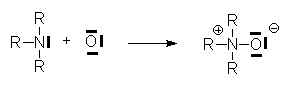
la flèche étant réservée à l’indication de la polarisation d’une liaison.
2.6. Complexes.
Selon un processus analogue, des liaisons souvent moins stables proviennent du don d’un doublet libre d’un atome électronégatif à un atome dont la couronne électronique est déficiente. on les appelle des complexes, n ou p :
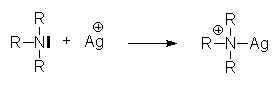
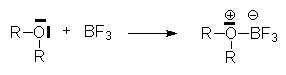
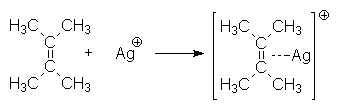
2.7. Liaison hydrogène.
Lorsqu’il est lié à des éléments très électronégatifs (F, O, N), l’atome d’hydrogène présente une déficience électronique suffisante pour lui permettre d’accepter partiellement un doublet n. Il en résulte une liaison faible, d’un type particulier, dite liaison hydrogène :
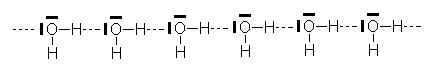
Cette liaison H est responsable des anomalies des propriétés physiques (Teb anormalement élevée, spectre d’absorption IR modifié, ...) et chimiques des molécules hydroxylées. Voici quelques exemples :
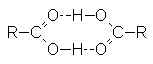 acides carboxyliques :
acides carboxyliques :
ce sont des dimères
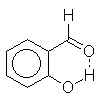
aldéhyde salicylique :
ici la Teb est abaissée par rapport à celle du phénol
2.8. Énergie de liaison.
L’énergie d’une liaison peut être déterminée par diverses méthodes : thermochimiques et spectroscopiques essentiellement. Lorsque la valeur de El est élevée, la liaison est stable. Dans les molécules symétriques, les El les plus élevées se rencontrent chez les atomes dont l’électronégativité est comprise entre 2 et 2,5 environ :
H — H : + 435,6 kJ.mol–1 C — C : + 345,3 kJ.mol–1
mais: F — F : + 153,0 kJ.mol–1 O — O : + 146,3 kJ.mol–1
Li — Li : + 110,8 kJ.mol–1 Na — Na : + 175,2 kJ.mol–1
Dans les molécules dissymétriques, El est d’autant plus élevée que la différence d’électronégativité est grande :
H — F : + 562,6 kJ.mol– 1 H — O : + 462,3 kJ.mol– 1
C — F : + 484,9 kJ.mol– 1 C — H : + 412,6 kJ.mol–1
Lorsque le caractère ionique l’emporte sur le caractère covalent, El diminue fortement : H — Li : + 244,5 kJ.mol–1
L’énergie d’une liaison multiple est plus grande que l’énergie d’une liaison simple. Dans le cas de C == C et de C º º C , l’incrément d’énergie dû à la liaison supplémentaire (p) est inférieur à El de C — C . Il est par contre plus important pour C == O et C º º N . La liaison H vaut 21 kJ.mol–1 environ.
2.8.1. Application au calcul de
l’énergie de réaction ![]()
Elle vaut la différence entre les énergies des liaisons rompues et celles des liaisons formées.
![]()
formation de deux liaisons H — Cl : libère 2 ´
(–431,4) kJ.mol–1
rupture d’une liaison H — H : nécessite 435,6 kJ.mol–1
rupture d’une liaison Cl — Cl : nécessite 242,4 kJ.mol–1
la somme de ces trois termes donne ![]() = –184,8 kJ.mol–1
= –184,8 kJ.mol–1
3. Acidité. Basicité.
Nous utiliserons les définitions de Brønstedt et Lowry (1923) et de Lewis (1923)
Brønstedt : les acides sont donneurs de protons, les bases accepteurs de protons. Les acides de Brønstedt : CH3COOH , ...
Lewis : les acides sont accepteurs de doublets n ou p , les bases donneurs de doublets.
Acides: H+, Ag+ , BF3 ,
AlCl3 , ...
Bases : HO– , NR3 , OR2 , ...
4. Notion de groupement fonctionnel
Voici les principaux groupes d’atomes dont les propriétés chimiques, particulières à chacun d’entre eux, seront étudiées. R– représente un groupement ne comportant généralement que C et H, et généralement saturé (par ex : C4H9–)
5. Isomérie