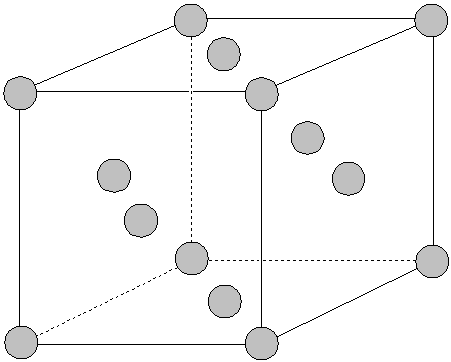
1. Structure.
Les rayons X permettent de déterminer la structure des métaux, ce qu’étudie la cristallographie. On en retire les distances interatomiques et la position des plans réticulaires. Par exemple le Fer g qui présente une maille CFC :

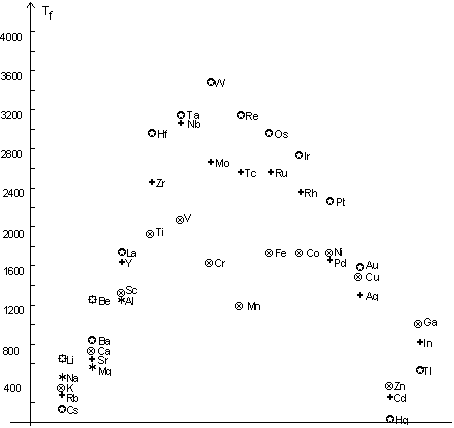
Les études thermodynamiques montrent que l’énergie réticulaire du métal va imposer la valeur de son enthalpie de sublimation, celle de la distance interatomique, et donc celles de la compacité et de la densité du métal. En fait, plus le nombre d’électrons impliqués dans la liaison métallique est grand, plus l’énergie réticulaire est forte :
Les métaux cristallisent sous la forme de trois structures principales: C.F.C., H.C. et C.C. , par exemple : – CC : Na , Fe a , Fe g
– CFC : Al , Fe g
– HC : Mg
1.3.1. Classification.
On distingue les propriétés mécaniques liées à la résistance (ténacité Þ traction ; dureté Þ pénétration ; résilience Þ choc) et à la mise en forme (malléabilité Þ mise en feuilles; ductilité Þ obtention de fils)
De O à A, l’allongement est proportionnel à
l’effort : domaine des déformations élastiques : ![]() où E est le module
de Young (Pour l’acier E = 200000 N/mm) . De A à B, c’est le domaine de
plasticité :
où E est le module
de Young (Pour l’acier E = 200000 N/mm) . De A à B, c’est le domaine de
plasticité : ![]() augmente plus vite que
augmente plus vite que ![]() . La suppression de
l’effort laisse un résidu d’allongement. En B : Si
. La suppression de
l’effort laisse un résidu d’allongement. En B : Si ![]() est le même, le
système se déforme tout seul et il y a rupture en C. Une région de striction
apparaît.
est le même, le
système se déforme tout seul et il y a rupture en C. Une région de striction
apparaît.
Ordres de grandeur :
|
Al recuit |
acier recuit (0,5% C) |
acier trempé (0,5% C) |
Cu recuit | |
|
|
30 |
400 |
700 |
20 |
|
|
50 |
700 |
1000 |
200 |
|
|
45 |
15 |
10 |
55 |
L’observation microscopique de la zone de striction montre des décrochements dans la section de la base suivant des plans obliques par rapport aux forces de traction : il y a glissement le long des plans réticulaires.
On montre aussi que des monocristaux métalliques obtenus avec beaucoup de soin sont beaucoup plus tenaces que les métaux (rapport de 1 à 10000).
Cela est dû aux défauts réticulaires : il y a rupture des périodicités du réseau. Les types de défauts réticulaires sont les suivants :
– défauts ponctuels (lacunes, atomes interstitiels, atomes étrangers, soit par insertion, soit par substitution)
– défauts linéaires : dislocations.
– défauts plans: défauts d’empilement.
Si l’on arrive à supprimer les
dislocations, le métal devient moins malléable, plus tenace, plus dur. Par
exemple : le Duralumin Cu , Al recuit. Il présente des plages d’un composé
intermédiaire ![]() qui s’opposent aux dislocations.
qui s’opposent aux dislocations.
La conductivité électrique : la résistivité est faible. Elle est limitée par les défauts du cristal et les vibrations thermiques (aux hautes températures : r = ¥ ). Certains semi-métaux sont semi-conducteurs (Si, Ge).
L’éclat métallique : les métaux réfléchissent énormément la lumière. Certains sont colorés. (Cu : rouge, Au : jaune)
La conductibilité thermique, due au nuage électronique, car l’agitation thermique des électrons se propage facilement, provoquant une élévation de température des parties non chauffées.
2. Modèle de la liaison métallique : le modèle des bandes.
Il a été proposé par BLOCH en 1928.
Il considère simplement que toutes les orbitales atomiques de même symétrie
appartenant aux N atomes se combinent linéairement pour donner ![]() OM liantes et
OM liantes et ![]() OM
antiliantes. C’est ainsi que l’on obtient des bandes d’énergie, permettant aux
électrons de prendre n’importe laquelle des N valeurs de l’énergie comprise
entre les valeurs relatives à l’OM de plus basse énergie l’OM de plus haute
énergie.
OM
antiliantes. C’est ainsi que l’on obtient des bandes d’énergie, permettant aux
électrons de prendre n’importe laquelle des N valeurs de l’énergie comprise
entre les valeurs relatives à l’OM de plus basse énergie l’OM de plus haute
énergie.
On parlera de bandes s, p, d, f . Les métaux présentent tous une bande de valence (souvent les bandes d, s ) et une bande de conduction (souvent la bande p ). Une de ces bandes est en général partiellement remplie.
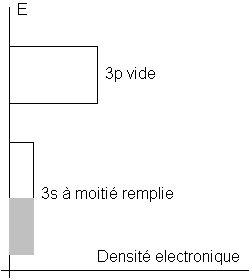 La bande s est ici à moitié remplie. Elle sert à la
fois de bande de valence et de bande de conduction. Les transitions vers les OM
vides de la bande p sont toutes permises. Tout le visible est ainsi
absorbé et réémis, d’où l’éclat métallique.
La bande s est ici à moitié remplie. Elle sert à la
fois de bande de valence et de bande de conduction. Les transitions vers les OM
vides de la bande p sont toutes permises. Tout le visible est ainsi
absorbé et réémis, d’où l’éclat métallique.
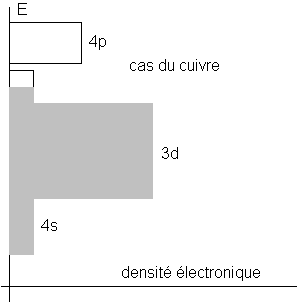 Ici, les bandes d et s servent de bandes de
valence et de conduction. Ces métaux sont donc de bons conducteurs de
l’électricité. Les transitions électroniques se font entre la bande d et
la bande s . Aussi, lorsque la bande d est complètement remplie et
la bande s aux trois quarts environ, les réémissions permises ne
concernent que les longueurs d’onde supérieures à 550 nm. Le rouge sera donc
réfléchi, le vert absorbé : c’est le cas du cuivre qui a un éclat
rouge.
Ici, les bandes d et s servent de bandes de
valence et de conduction. Ces métaux sont donc de bons conducteurs de
l’électricité. Les transitions électroniques se font entre la bande d et
la bande s . Aussi, lorsque la bande d est complètement remplie et
la bande s aux trois quarts environ, les réémissions permises ne
concernent que les longueurs d’onde supérieures à 550 nm. Le rouge sera donc
réfléchi, le vert absorbé : c’est le cas du cuivre qui a un éclat
rouge.
2.3. Semi-conducteurs et isolants.
Dans ces cas-là, la bande de valence est pleine (c’est un peu plus compliqué que dans le cas des métaux), et la bande de conduction vide. Si la différence d’énergie (gap)
entre la plus haute OM de la bande de valence et la plus basse OM de la bande de conduction est importante (5,2 eV pour le diamant), nous sommes en présence d’un isolant. Si ce gap est inférieur à 1,2 eV (Si: 1,1 eV; Ge: 0,7 eV), nous sommes en présence d’un semi-conducteur intrinsèque. Un léger échauffement va provoquer le passage des électrons vers la bande de conduction : il y a apparition d’une certaine conductibilité :
![]() , où Eg
est la valeur du gap (en J), et k la constante de Boltzmann :
, où Eg
est la valeur du gap (en J), et k la constante de Boltzmann : ![]()
 – de
type N : On rajoute très peu d’impureté d’un élément possédant plus d’électrons
de valence que Si par exemple, et substituant parfaitement un de ces atomes
(0,01% de P par exemple). Le faible nombre d’électrons supplémentaires va se
retrouver dans la bande de valence et assurer la faible conductivité.
– de
type N : On rajoute très peu d’impureté d’un élément possédant plus d’électrons
de valence que Si par exemple, et substituant parfaitement un de ces atomes
(0,01% de P par exemple). Le faible nombre d’électrons supplémentaires va se
retrouver dans la bande de valence et assurer la faible conductivité.
 – de type P : On
rajoute très peu d’impureté d’un élément possédant moins d’électrons de valence
que Si (0,01% de Ga par exemple). Ici ce seront des trous positifs qui
apparaîtront dans la bande de valence et assureront la
conduction.
– de type P : On
rajoute très peu d’impureté d’un élément possédant moins d’électrons de valence
que Si (0,01% de Ga par exemple). Ici ce seront des trous positifs qui
apparaîtront dans la bande de valence et assureront la
conduction.
Ce sont des mélanges binaires, ternaires, voire quaternaires, dont l’un des éléments est un métal : on les obtient par fusion, puis cristallisation, ou bien par frittage de poudres métalliques à fortes pressions. On peut également les obtenir par dépôt électrolytique simultané des deux métaux.
Dans les solutions solides, la structure de l’un des constituants est conservée, avec quelques modifications. Les "phases intermédiaires" sont de véritables composés chimiques.
3.2.1. Si le remplacement des atomes
d’un métal A par ceux d’un métal B ne modifie pas la structure de A, ce remplacement est possible, et est à l’origine de l’alliage de substitution : l’or cristallise en cfc. On peut remplacer des atomes d’or par des atomes d’argent.
Le remplacement d’un métal par un autre ne doit pas changer la maille : les deux métaux A et B doivent satisfaire à deux règles :
* règle du facteur de taille (règle
de Home Rathery) ; Le rapport ![]() doit être compris entre 0,93 et 1,07. Il y a alors
miscibilité totale. Si ce rapport ne respecte pas la règle précédente, il n’y a
que miscibilité partielle. L’argent ayant pratiquement le même rayon métallique
que l’or (voir la contraction des lanthanides), sa miscibilité avec l’or est
bien totale.
doit être compris entre 0,93 et 1,07. Il y a alors
miscibilité totale. Si ce rapport ne respecte pas la règle précédente, il n’y a
que miscibilité partielle. L’argent ayant pratiquement le même rayon métallique
que l’or (voir la contraction des lanthanides), sa miscibilité avec l’or est
bien totale.
* règle du facteur de valence. La miscibilité est d’autant plus grande que les structures électroniques des couches externes des deux atomes sont voisines. Exemple : le nickel est soluble à 100% dans le cuivre, le gallium à 20%, le germanium à 10%.
Le remplacement se fait au hasard. On ne peut donner que la composition moyenne de l’alliage.
Il y a des sites vides dans les cristaux (dans cfc : 4 sites octaédriques et 8 sites tétraédriques par maille). On obtient des solutions solides d’insertion lorsque ces lacunes cristallines sont occupées par des atomes de petite taille : H , B , C , N . Seul H peut occuper les petits sites (tétraédriques par ex.).
Le palladium (cfc) est par exemple poreux à l’hydrogène. C’est le métal qui en absorbe le plus Þ hydrogénation catalytique.
Les aciers sont des solution solides d’insertion de C dans Fe .
Autres exemples : ThC , HfC , ![]() .
.
Ce sont des composés définis dans lesquels la notion de valence n’a plus aucune signification.
exemples : dans le laiton, on trouve
des cristaux de CuZn , ![]() ,
, ![]() .
.
dans la fonte, on trouve la
cémentite ![]()
Le siliciure de magnésium en est un
autre exemple ![]()
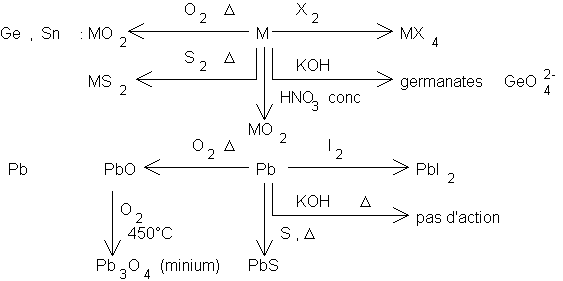
4. Etude comparative des propriétés chimiques des métaux.
Il faut distinguer les métaux de transition et les autres. Les métaux considérés sont ceux qui, à l’état d’oxydation 0 , ont un éclat métallique, soit :
– les alcalins – les alcalino-terreux sauf Be
– Al , Ga , In , Tl – Si , Sn , Pb
– éventuellement Sb et Bi
Les trois dernières séries ont des propriétés semi-conductrices marquées et sont proches des non métaux.
Caractérisés par la stabilité du
![]() .
Ils forment peu de complexes, peu de composés insolubles, à cause de la forte
solvatation (et donc stabilisation) du cation dans l’eau . Les métaux sont très
réducteurs (potentiels rédox < 2,7 V).
.
Ils forment peu de complexes, peu de composés insolubles, à cause de la forte
solvatation (et donc stabilisation) du cation dans l’eau . Les métaux sont très
réducteurs (potentiels rédox < 2,7 V).
 C’est le
C’est le
![]() qui
est le plus stable. Les potentiels rédox sont toujours très négatifs (Be : 1,7 V
; Mg : 2,34 V ; &Ca : 2,87 V ; Ba : 2,9 V). Ils forment quelques complexes
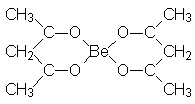
organiques, par exemple le bis-acétylacétonato-berryllium :
qui
est le plus stable. Les potentiels rédox sont toujours très négatifs (Be : 1,7 V
; Mg : 2,34 V ; &Ca : 2,87 V ; Ba : 2,9 V). Ils forment quelques complexes
organiques, par exemple le bis-acétylacétonato-berryllium :
Ils donnent surtout des complexes
![]() , et
des sels insolubles avec les anions fortement chargés:
, et
des sels insolubles avec les anions fortement chargés: ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Stabilité du ![]() , mais apparition
progressive du
, mais apparition
progressive du ![]() (
(![]() par exemple). Les potentiels rédox sont très contrastés :
–1,67V pour
par exemple). Les potentiels rédox sont très contrastés :
–1,67V pour ![]() , et beaucoup plus proches de 0 pour les autres, car la taille
du cation augmente alors beaucoup moins que celle du numéro atomique. Le cation
est alors moins stable et le potentiel rédox
, et beaucoup plus proches de 0 pour les autres, car la taille
du cation augmente alors beaucoup moins que celle du numéro atomique. Le cation
est alors moins stable et le potentiel rédox ![]() est moins
négatif :
est moins
négatif :
![]() : – 0,52 V
: – 0,52 V ![]() : + 0,72V
: + 0,72V
![]() : – 0,34 V, car
: – 0,34 V, car ![]() est plus stable que
est plus stable que ![]()
Ces éléments donnent des complexes stables, et peu de composés insolubles, excepté les oxydes.
Le silicium a un caractère non métallique marqué. Il donne donc beaucoup de composés covalents monomères et polymères. Nous le verrons plus en détail.
Les autres éléments Ge , Sn , Pb ont
tendance à former des ions ![]() , et ont un caractère de plus en plus métallique.
, et ont un caractère de plus en plus métallique. ![]() donne des
composés ioniques, les autres, surtout des composés covalents.
donne des
composés ioniques, les autres, surtout des composés covalents.
Les potentiels rédox sont proches de
0 : ![]() : 0 V ;
: 0 V ; ![]() : -0,136 V ;
: -0,136 V ; ![]() : –0,126 V
.
: –0,126 V
.
Réactions principales de ces éléments :
|
en nanomètres |
Cr |
Mo |
W |
|
Rayon M4+ |
0,055 |
0,068 |
0,068 |
|
Rayon M6+ |
0,052 |
0,062 |
0,067 |
|
Rayon métallique |
0,127 |
0,139 |
0,139 |
|
Fluorures |
|
|
|
On peut les délimiter en deux blocs
: le bloc "d", du scandium au zinc, de l’yttrium au cadmium, du lutétium au
mercure, et le bloc "f", avec les lanthanides et les actinides. Il est à
remarquer la très grande similitude des 14 lanthanides ![]() avec une
sous-couche "f" très profonde, donc ne faisant pas partie de la couche de
valence. Par contre la sous-couche 5f est bien plus proche des sous couches 6d
et 7s , si bien que les propriétés chimiques des actinides sont très différentes
les unes des autres (cf. le cours sur l’uranium).
avec une
sous-couche "f" très profonde, donc ne faisant pas partie de la couche de
valence. Par contre la sous-couche 5f est bien plus proche des sous couches 6d
et 7s , si bien que les propriétés chimiques des actinides sont très différentes
les unes des autres (cf. le cours sur l’uranium).
Les métaux de transition se dissolvent dans les acides dilués, exception faite des métaux nobles ( Ru , Pd , Ag , Ir , Os , Pt , Au ). Leur potentiel d’électrode est > 0.
Ils présentent tous plusieurs degrés
d’oxydation et forment beaucoup de complexes. L’existence de ceux-ci explique la
stabilité des divers degrés d’oxydation. Le ruthénium donne par exemple 9 degrés
d’oxydation : ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Les degrés d’oxydation élevés sont stabilisés par des ligands très électronégatifs. (F ou O) . Par contre les ligands faiblement électronégatifs ne stabilisent que les bas degrés d’oxydation.
On constate une différence entre les propriétés chimiques des éléments de la quatrième période, et celles des éléments des cinquième et sixième périodes (elles sont ici pratiquement identiques). Les électrons "d" participent plus aux liaisons et donc les degrés d’oxydation supérieurs sont plus stables. On explique cette similitude par la contraction des lanthanides. Les rayons ioniques et covalents sont semblables. Exemples :
Les composés à haut degré
d’oxydation sont covalents ( ![]() est liquide), les autres plutôt ioniques.
est liquide), les autres plutôt ioniques.
Il y a environ 9 manières générales d’obtenir les métaux à partir de leur minerai. Généralement ceux ci sont tout d’abord transformés en oxydes ou en halogénures. On trouve aussi certains métaux à l’état natif. Le tableau ci-après donne les différentes méthodes appliquées aux oxydes et aux halogénures.
|
Électrolyse | ||||
|
des chlorures fondus avec fondants éventuels |
des oxydes avec fondant fluorure |
Réduction des oxydes par Na (sodiothermie) et par Ca |
Magnésiothermie |
Aluminothermie (réduction des oxydes) |
|
Alcalins (fondant CaCl2 pour NaCl)
Béryllium (fondant NaCl pour BeCl2) Scandium (fondant KCl + LiCl pour ScCl3) Tantale (à partir de K2TaF7) |
ALUMINIUM
Gallium
Cérium |
Lanthane Gadolinium Thorium (même méthode de purification) |
|
Calcium Strontium Baryum Vanadium Niobium (à partir de Chrome Molybdène Tungstène Manganèse Cobalt |
|
Réduction des oxydes par le carbone |
Réduction des oxydes par l’hydrogène |
Coupellation |
État natif |
Réactions particulières |
|
Silicium (purification par la zone fondue) Germanium Étain Antimoine Bismuth Molybdène Cuivre Zinc FER |
Germanium Molybdène Tungstène (pour les filaments) Rhénium |
PLOMB
MERCURE
|
Ruthénium Rhodium Palladium Osmium Iridium Platine Argent Or |
Magnésium
Indium
Nickel
|
6. Préparation industrielle de l’aluminium.
6.1 Données théoriques.
L’énergie réticulaire de ![]() étant
très élevée, il est difficile de concevoir une méthode réductrice du type
calciothermie, donnant de bons rendements. Ce sera donc l’électrolyse qui sera
adoptée.
étant
très élevée, il est difficile de concevoir une méthode réductrice du type
calciothermie, donnant de bons rendements. Ce sera donc l’électrolyse qui sera
adoptée.
La température de fusion de l’alumine est de 2000°C. Il faudra un fondant. L’autre problème réside dans la faible température de fusion de Al et surtout dans sa faible densité : il flotterait au-dessus du bain électrolytique et donc se consumerait à l’air dès que formé. Il faut un mélange fondant de densité plus faible.
Le mélange fondant contient 10%
d’alumine, 70% de cryolithe ![]() et 20% de fluorine CaF2. Sa température de
fusion est de 950°C. Sa densité est inférieure à celle de l’aluminium.
et 20% de fluorine CaF2. Sa température de
fusion est de 950°C. Sa densité est inférieure à celle de l’aluminium.
 Caractéristiques
électrique de l’électrolyseur : E = 4,3 V et I = 1000 A. L’effet joule maintient
la température à 1000°C.
Caractéristiques
électrique de l’électrolyseur : E = 4,3 V et I = 1000 A. L’effet joule maintient
la température à 1000°C.
Ions en solution : ![]() ;
; ![]() ;
; ![]() ;
; ![]() . L’alumine
. L’alumine ![]() est
dissoute sous forme de paires d’ions :
est
dissoute sous forme de paires d’ions : ![]() ,
, ![]() qui ne sont pas
encore entièrement dissociés.
qui ne sont pas
encore entièrement dissociés.
CATHODE : y arrivent ![]() et
et ![]() .
. ![]() étant le moins
réducteur, la réaction est la suivante :
étant le moins
réducteur, la réaction est la suivante : ![]() .
.
Puis Na réagit avec ![]() :
:
![]()
ANODE : ![]()
![]()
Le dégagement d’oxygène brûle l’anode. Le brassage est continuel.
Ce procédé donne un aluminium à 99,5% de pureté (contient un peu de fer et de silicium). Il existe deux procédés de purification :
* électrolyse à anode soluble qui donne un Al à 99,99%
* procédé à fusion de zone : un barreau d’aluminium à 99,5% passe lentement au travers d’un électroaimant qui y crée des courants de Foucault. L’aluminium fond sur une épaisseur de quelques millimètres. Les impuretés, non fusibles, surnagent dans la zone liquide et y restent, alors que l’aluminium solide pur à 99,99% sort de l’électroaimant.