Spectrographie de masse
Le spectrographe de masse consiste à ioniser par des électrons une molécule A. Celle-ci va donc donner une entité A+ ayant perdu un électron. A+ va pouvoir se scinder en plusieurs groupements (chargé + ou non) plus petits, ou bien se réarranger.
On accélère alors ces particules par un champ
électrique, puis elles sont déviées par un champ magnétique. On montre que la
déviation est proportionnelle à ![]() (ici
à
(ici
à ![]() ). Un
spectrographe de masse dan lequel on ne modifie aucun paramètre va pouvoir être
étalonné. Il sera étalonné en masses molaires, puisque e est constant. Le nombre
de molécules aura un incidence sur la plaque sensible du détecteur : plus
nombreux sont les ions d’un type donné, plus intense sera la tache obtenue.
Actuellement, les détecteurs informatisés permettent d’obtenir directement un
spectre étalé.
). Un
spectrographe de masse dan lequel on ne modifie aucun paramètre va pouvoir être
étalonné. Il sera étalonné en masses molaires, puisque e est constant. Le nombre
de molécules aura un incidence sur la plaque sensible du détecteur : plus
nombreux sont les ions d’un type donné, plus intense sera la tache obtenue.
Actuellement, les détecteurs informatisés permettent d’obtenir directement un
spectre étalé.
Voici un schéma simplifié d’un spectrographe de masse :
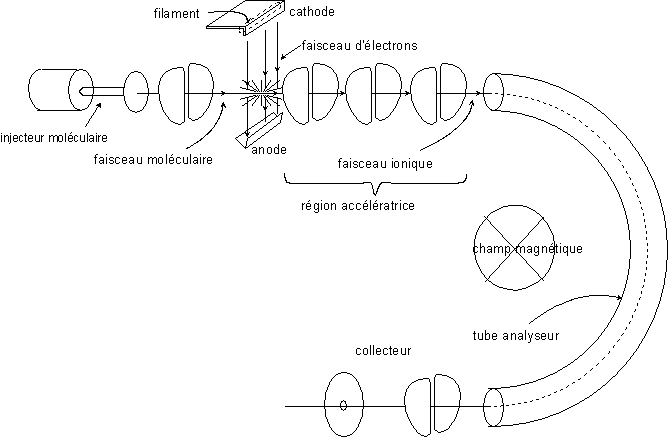
Soit v la vitesse de la particule ionisée (de
charge positive) entrant dans la zone où règne le champ magnétique. Elle est
soumise à le force centrale ![]() , soit,
puisque pour l’ion qui effectivement sortira du tube analyseur
, soit,
puisque pour l’ion qui effectivement sortira du tube analyseur ![]() est
perpendiculaire à
est
perpendiculaire à ![]() , mg = F = evB . Ce mouvement étant à accélération
centrale,
, mg = F = evB . Ce mouvement étant à accélération
centrale, ![]() où R est le rayon axial du tube analyseur. On obtient donc :
où R est le rayon axial du tube analyseur. On obtient donc :
![]() . La masse de l’ion analysé sera donc d’autant plus petite que
la vitesse d ’entrée dans le tube analyseur sera grande. Ainsi, si tous les
ions sont accélérés à la même vitesse, seul celui qui respecte la condition
ci-dessus sera analysé. On pourra faire varier cette vitesse pour analyser un à
un tous ces ions (on obtiendra un impact sur le collecteur d’autant plus intense
que la quantité d’ions du même type sera plus élevée). On pourra donc établir un
spectre, dit spectre de masse, donnant l’intensité de ces impacts en fonction de
la masse molaire (proportionnelle à m) de ces ions.
. La masse de l’ion analysé sera donc d’autant plus petite que
la vitesse d ’entrée dans le tube analyseur sera grande. Ainsi, si tous les
ions sont accélérés à la même vitesse, seul celui qui respecte la condition
ci-dessus sera analysé. On pourra faire varier cette vitesse pour analyser un à
un tous ces ions (on obtiendra un impact sur le collecteur d’autant plus intense
que la quantité d’ions du même type sera plus élevée). On pourra donc établir un
spectre, dit spectre de masse, donnant l’intensité de ces impacts en fonction de
la masse molaire (proportionnelle à m) de ces ions.
1.2. Utilisation des spectres de masse.
Le nombre d’ions de chaque type est en fait dépendant de la stabilité relative de chacun de ces ions. Voici le spectre de masse du toluène.
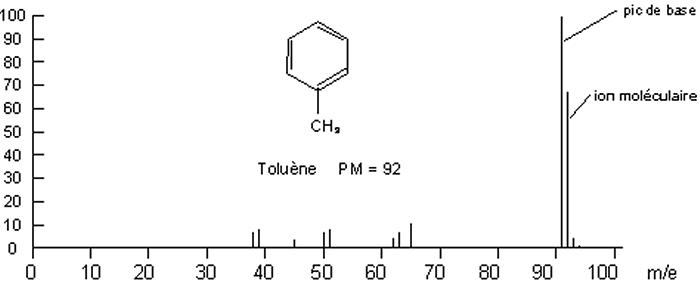
Voici un tableau récapitulatif du spectre précédent :
|
m/e |
38 |
39 |
45 |
50 |
51 |
62 |
63 |
65 |
91 |
92 |
93 |
94 |
|
% du pic de base |
4,4 |
5,3 |
3,9 |
6,3 |
9,1 |
4,1 |
8,6 |
11 |
100 |
68 |
4,9 |
0,21 |
Abondance isotopique :
|
m/e |
92 (M) |
93 (M+1) |
94 (M+2) |
|
% du pic moléculaire |
100 |
7,23 |
0,29 |
 On trouve dans
ce spectre un pic important : le pic de base, et on mesure les autres pics en %
par rapport au pic de base Le pic de l’ion moléculaire (ici
On trouve dans
ce spectre un pic important : le pic de base, et on mesure les autres pics en %
par rapport au pic de base Le pic de l’ion moléculaire (ici ![]() , avec un
électron p enlevé au cycle) est plus petit que le pic de base (qui est ici
, avec un
électron p enlevé au cycle) est plus petit que le pic de base (qui est ici ![]() ou encore formé par réarrangement). On retrouve aussi des pics
de masse molaire M+1 et M+2 provenant des isotopes du carbone, de l’azote, de
l’oxygène,.... Bien sûr, la probabilité de trouver deux isotopes de faible
abondance dans une même molécule est très faible, aussi M+2 est-il très
petit.
ou encore formé par réarrangement). On retrouve aussi des pics
de masse molaire M+1 et M+2 provenant des isotopes du carbone, de l’azote, de
l’oxygène,.... Bien sûr, la probabilité de trouver deux isotopes de faible
abondance dans une même molécule est très faible, aussi M+2 est-il très
petit.
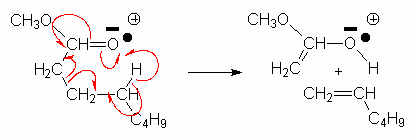
La réaction ayant lieu lors du bombardement peut s’écrire ainsi :
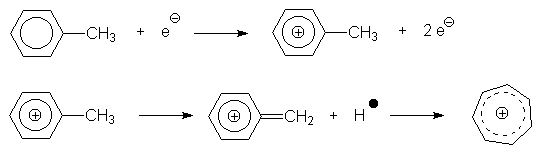
|
Élément |
Masse atomique |
Nucléide |
Masse |
Abondance
relative par rapport |
|
H |
1,00797 |
1H D (ou 2H) |
1,00783 2,01410 |
100 0,016 |
|
C |
12,01115 |
12C 13C |
12,00000 13,00336 |
100 1,08 |
|
N |
14,0067 |
14N 15N |
14,0031 15,0001 |
100 0,38 |
|
O |
15,9994 |
16O 17O 18O |
15,9949 16,9991 17,9992 |
100 0,04 0,20 |
|
F |
18,9984 |
19F |
18,9984 |
100 |
|
Si |
28,086 |
28Si 29Si 31Si |
27,9769 28,9738 30,9738 |
100 5,10 3,35 |
|
P |
30,974 |
31P |
30,974 |
100 |
|
S |
32,064 |
32S 33S 34S |
31,9721 32,9715 33,9679 |
100 0,78 4,40 |
|
Cl |
35,453 |
35Cl 37Cl |
34,9689 36,9659 |
100 32,5 |
|
Br |
79,909 |
79Br 81Br |
78,9183 80,9163 |
100 98 |
|
I |
126,904 |
127I |
126,904 |
100 |
3. Détermination des formules brutes.
Le pic parent est le pic moléculaire, c’est-à-dire le pic provenant d’une molécule dans laquelle n’entrent que les isotopes de plus grande abondance. En fonction du nombre de chaque atome présent, pour plusieurs molécules possèdant le même pic moléculaire, le pourcentage relatif des pics isotopiques par rapport au pic parent va varier.
3.1. Par exemple, dans le cas de l’éther
diisopropylique ![]() de
formule brute
de
formule brute ![]() , de pic moléculaire 102, les pics isotopiques ont un
pourcentage relatif de 7,8 (103) et 0,5 (104). Il existe des tables qui donnent
tous les arrangements possibles de C, H, O et N donnant un pic moléculaire de
102 avec les pourcentages relatifs de M+1 et M+2. On recherche dans la table la
formule (compatible avec les autres spectres) , respectant la valence des
atomes, qui possède des pourcentages relatifs voisins de ceux obtenus par
l’expérience.
, de pic moléculaire 102, les pics isotopiques ont un
pourcentage relatif de 7,8 (103) et 0,5 (104). Il existe des tables qui donnent
tous les arrangements possibles de C, H, O et N donnant un pic moléculaire de
102 avec les pourcentages relatifs de M+1 et M+2. On recherche dans la table la
formule (compatible avec les autres spectres) , respectant la valence des
atomes, qui possède des pourcentages relatifs voisins de ceux obtenus par
l’expérience.
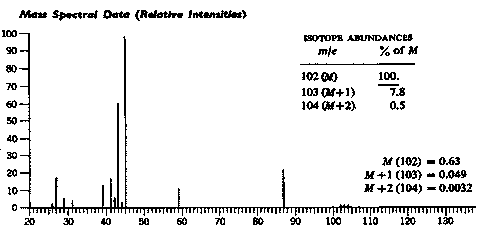
On trouve les formules suivantes :
C7H2O : M+1 : 7,64% , M+2 : 0,45% . Le nombre d’hydrogènes est manifestement beaucoup trop faible en regard du spectre RMN par exemple.
C8H6 pourrait convenir, mais serait sans doute aromatique : donc incompatible avec les spectres RMN et IR :
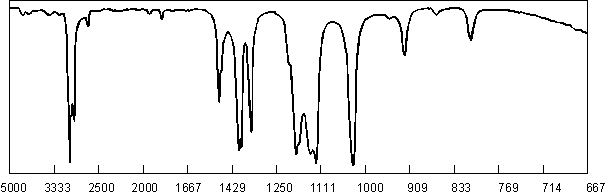
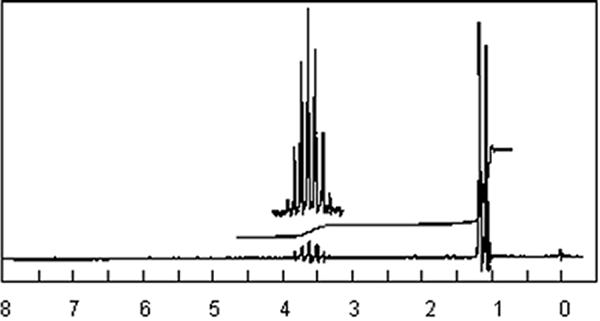
Le nombre d’atomes d’hydrogène doit impérativement être pair, sauf lorsqu’il y a un nombre impair d’azote dans la molécule. Ainsi C7H4N , C6NO , C5N3 , C5H12NO , C4H12N3 , etc... sont impossibles. Il ne reste donc que C6H14O .
Il existe une formule empirique qui permet de retrouver le nombre d’atomes de carbone d’une molécule. Si cette molécule contient un nombre n d’atomes d’azote, cette formule s’écrit :
![]()
Manifestement il n’y a ici aucun atome d’azote , on doit donc trouver :
NC = 7,8 / 1,2 = 6,5 , ce » qui est malgré tout assez imprécis.
ici : M (118) : 100
M + 1 : 7,95
M + 2 : 4,96
Lorsque M + 2 n’est pas environ dix fois plus petit que M + 1 ou que celui-ci n’est pas environ dix fois plus petit que M , il y a un autre élément que C, N, O, H . Dans le tableau des isotopes, on recherche un élément pour lequel M + 1 » 0 – 1 et M + 2 » 4 – 5 . On trouve bien sûr le Soufre. On retranche alors les abondances relatives de 33S et 34S à M + 1 et M + 2 :
M (–S) (118 – 32=86): 100
M (–S) + 1 : 7,95 – 0,78 = 7,17
M (–S) + 2 : 4,96 – 4,40 = 0,56
M (–S) présente des pourcentages compatibles avec la seule présence de C, N, O, H . Dans la table, à M = 86 (pour un composé saturé, au vu du spectre RMN) on ne trouve comme possibles que, ainsi queC5H10O et C4H10N2 (M+1 trop faible),
Seul C6H14 possède un M+1 compatible. La formule brute est donc C6H14S , donc un thiol ou un sulfure. Le petit pic à 2600 cm–1 en IR montre la présence de S – H :
Le spectre RMN permet de déterminer la formule développée.
ici : M (146) : 100 Ici, aucun élément isolé ne peut être isolé.
M + 2 : 93 Il faut alors penser à un élément double, voire
M + 4 : 30 triple, possèdant un isotope +2 important :
C’est le cas de Cl , la configuration existante indiquant la présence de 3 atomes de chlore dans la molécule. Il reste alors une masse de 41, ce qui correspond soit à CHN2 (non) , C2HO (non) , C2H3N (impossible, car le nombre d’H en présence d’un azote doit être pair) et enfin C3H5.
Voici le tableau donnant le nombre d’halogène présent en fonction du pourcentage relatif des pics M + 2 , M + 4 , etc...
|
% M + 2 |
% M + 4 |
% M + 6 |
% M + 8 |
% M + 10 |
% M + 12 | |
|
Br1 |
97,9 |
|||||
|
Br2 |
195 |
95,5 |
||||
|
Br3 |
293 |
286 |
93,4 |
|||
|
Cl1 |
32,6 |
|||||
|
Cl2 |
65,3 |
10,6 |
||||
|
Cl3 |
97,8 |
31,9 |
3,47 |
|||
|
Cl4 |
131 |
63,9 |
14 |
1,15 |
||
|
Cl5 |
163 |
106 |
34,7 |
5,66 |
0,37 |
|
|
Cl6 |
196 |
161 |
69,4 |
17 |
2,23 |
0,11 |
|
Br1Cl1 |
130 |
31,9 |
||||
|
Br2Cl1 |
228 |
159 |
31,2 |
|||
|
Cl2Br1 |
163 |
74,4 |
10,4 |
Nous voyons apparaître sur les spectres de masse des ions de masse inférieure au pic parent. Il s’agit de structures obtenues par fragmentation des ions parents.
Ils sont peu intéressants. Ils donnent surtout des cations éthyl, propyl, butyl et pentyl, quel que soit l’alcane étudié.
4.2. Dérivés de type R — CR’R" — X , où X est OH , NH2 , Cl ou Br.
il y a rupture de la liaison en a du –OH :
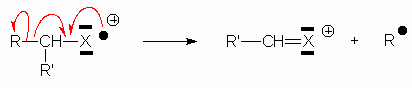
Puis la fragmentation de ![]() ramène aux résultats
obtenus pour les alcanes : par exemple, dans le cas du pentan-1-ol, on retrouve
ramène aux résultats
obtenus pour les alcanes : par exemple, dans le cas du pentan-1-ol, on retrouve
![]() (29) ,
(29) , ![]() (43) ,
(43) ,
![]() (57) . Dans le cas des alcools II et III, on obtient, après une
première fragmentation,
(57) . Dans le cas des alcools II et III, on obtient, après une
première fragmentation, ![]() et
et ![]() . Voici l’exemple des pentan-2-ol et 2-méthyl butan-2-ol
:
. Voici l’exemple des pentan-2-ol et 2-méthyl butan-2-ol
:
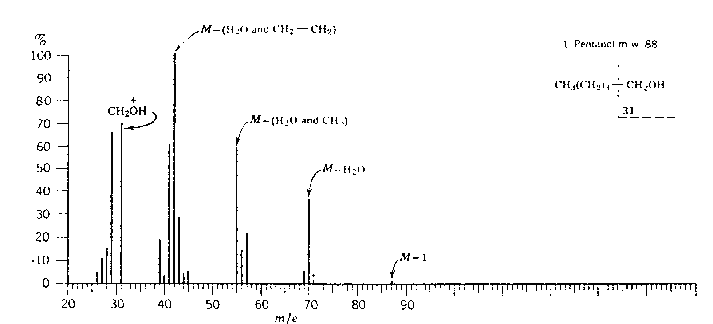
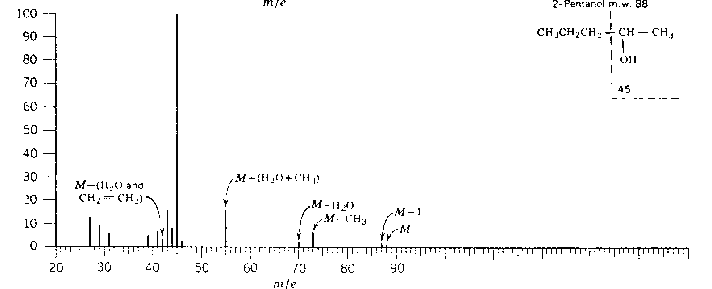
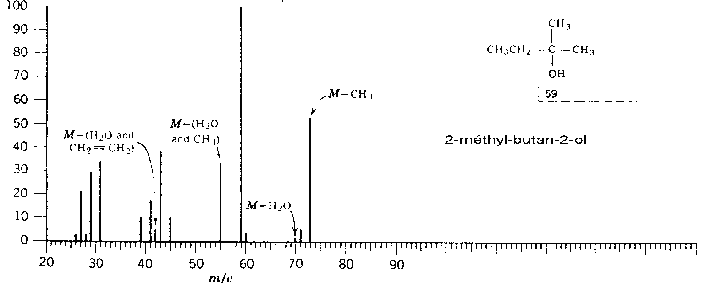
Il y a également rupture en a de la fonction carbonyle
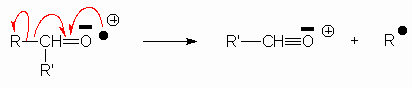
On obtient des pics à 43 (![]() ) , 57 , 71 ...
) , 57 , 71 ...
Exemple de la p-chlorobenzophénone :
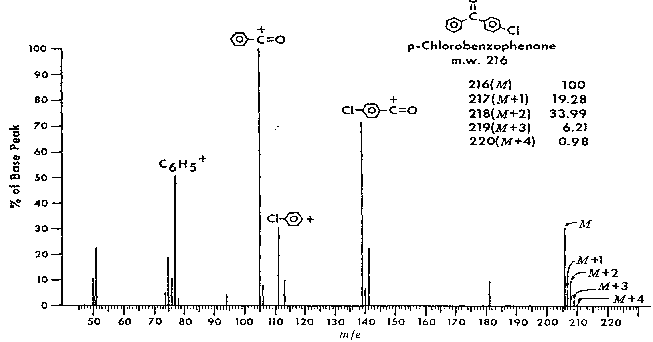
De même les aldéhydes peuvent-ils perdre H , et le
spectre de masse présentera un pic M – 1. Ils présenteront aussi le pic 29 :
![]() .
.
4.4. Réarrangement de Mac Lafferty.
Il se rencontre pour les dérivés carbonylés (ou les esters)chaîne aliphatique de plus de 3 carbones
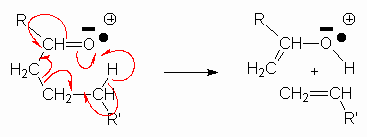
Ainsi, l’octanoate de méthyle donnera t-il un pic de base à 74 :