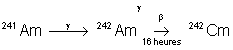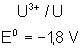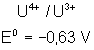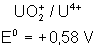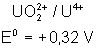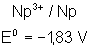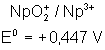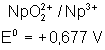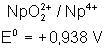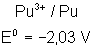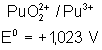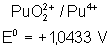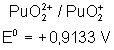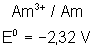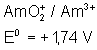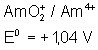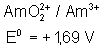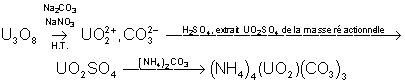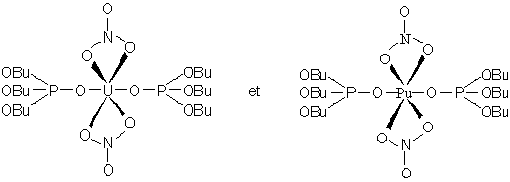1. Les
Actinides
1.1.
Existence.
Les actinides sont tous des éléments
radioactifs. Certains sont naturels (Ac, Th, Pa, U et sans doute Pu). Les autres
sont obtenus artificiellement. Les tableaux suivants montrent quelques unes de
leurs propriétés.
Propriétés atomiques et
électroniques
|
Numéro atomique |
Symbole |
Nom |
Configuration
électronique |
Température de fusion
(°C) |
Rayon
métallique (nm) |
Rayon ionique M3+
(nm) |
|
89 |
Ac |
Actinium |
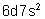
|
1050 |
1,88 |
1,11 |
|
90 |
Th |
Thorium |
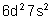
|
1750 |
1,795 |
|
|
91 |
Pa |
Protactinium |
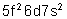
|
1560 |
1,64 |
|
|
92 |
U |
Uranium |
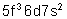
|
1132 |
1,57 |
1,03 |
|
93 |
Np |
Neptunium |
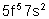
|
639 |
1,56 |
1,01 |
|
94 |
Pu |
Plutonium |
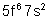
|
640 |
1,60 |
1,00 |
|
95 |
Am |
Américium |
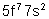
|
944 |
1,74 |
0,99 |
|
96 |
Cm |
Curium |
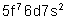
|
1350 |
1,75 |
0,985 |
|
97 |
Bk |
Berkélium |
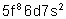
|
986 |
1,76 |
0,98 |
|
98 |
Cf |
Californium |
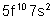
|
|
|
0,977 |
|
99 |
Es |
Einsteinium |
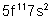
|
|
|
|
|
100 |
Fm |
Fermium |
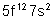
|
|
|
|
|
101 |
Md |
Mendélévium |
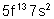
|
|
|
|
|
102 |
No |
Nobélium |
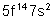
|
|
|
|
|
103 |
Lw |
Lawrencium |
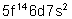
|
|
|
|
|
104 |
Rf
Ku |
Rutherfordium
Kurtchatovium |
|
|
|
|
|
105 |
Ha |
Hahnium |
|
|
|
|
Les trois éléments les plus
abondants sont le thorium, 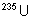 et
et 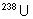 . Les autres éléments naturels proviennent de ces trois
là. On a récemment trouvé des traces de Np et Pu dans l’uranium
naturel.
. Les autres éléments naturels proviennent de ces trois
là. On a récemment trouvé des traces de Np et Pu dans l’uranium
naturel.
Propriétés nucléaires
|
Isotopes |
Temps de
demi-vie |
Obtention |
|
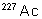
|
21,7 ans |
Naturel : 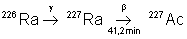 |
|
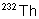
|
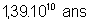
|
Naturel : le seul
isotope |
|
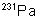
|
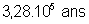
|
Naturel : 0,34 ppm dans le
minerai d’uranium (pechblende) |
|
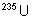
|
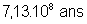
|
Naturel :
0,7204% |
|
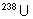
|
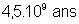
|
Naturel :
99,2739% |
|
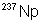
|
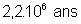
|
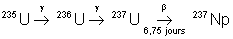
|
|
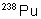
|
86,4 ans |
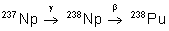
|
|
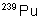
|
24,4 ans |
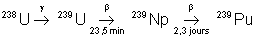
|
|
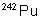
|
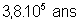
|
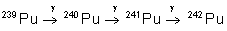
|
|
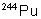
|
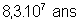
|
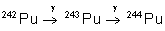
|
|
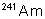
|
433 ans |
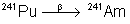
|
|
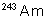
|
7650 ans |
|
|
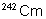
|
162,5 jours |
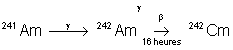
|
|
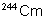
|
17,6 ans |
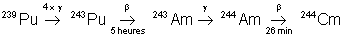
|
|
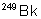
|
312 jours |
|
|
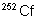
|
2,57 jours |
|
1.2. Degrés
d’oxydation.
Comme les lanthanides, le degré
d’oxydation +3 est le plus courant, mais du thorium au Berkélium, le degré
d’oxydation +4 existe, et est parfois plus stable (pour Th, Pa et U). Les degrés
+5 de Pa à Am, +6 de U à Am et +7 pour Np et Pu sont aussi
représentés.
Voici les potentiels rédox normaux
de quelques couples intéressant les actinides depuis Th jusqu’à Am , à pH = 0
:
|
Potentiels rédox de
: |
|
Thorium |
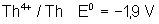
|
|
Protactinium |
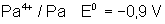
|
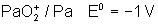
|
|
Uranium |
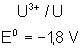
|
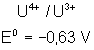
|
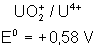
|
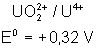
|
|
Neptunium |
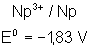
|
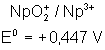
|
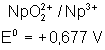
|
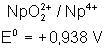
|
|
Plutonium |
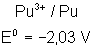
|
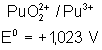
|
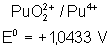
|
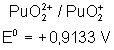
|
|
Américium |
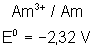
|
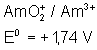
|
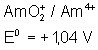
|
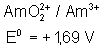
|
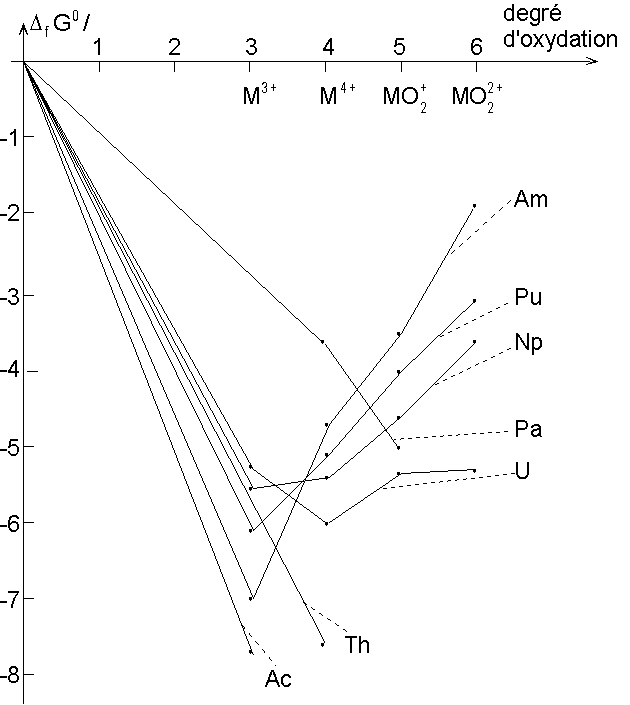
Le tracé du diagramme de Frost pour
ces différents métaux montre les stabilités suivantes :
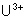 : (rouge brun) : oxydé lentement
par l’eau, rapidement par l’air en
: (rouge brun) : oxydé lentement
par l’eau, rapidement par l’air en 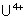 .
.
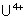 : (vert) : stable.
Oxydé lentement par l’air en
: (vert) : stable.
Oxydé lentement par l’air en 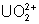 .
.
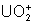 : : instable. Se
dismute en
: : instable. Se
dismute en 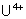 et
et 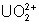 .
.
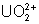 : (jaune) : très stable, difficile
à réduire.
: (jaune) : très stable, difficile
à réduire.
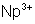 : (violet) : stable
dans l’eau. Oxydé par l’air en
: (violet) : stable
dans l’eau. Oxydé par l’air en 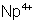 .
.
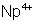 : (vert-jaune) :
stable. Oxydé lentement par l’air en
: (vert-jaune) :
stable. Oxydé lentement par l’air en 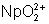 .
.
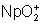 : (vert) : stable.
: (vert) : stable.
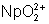 : (rose) : stable. Facilement
réduit.
: (rose) : stable. Facilement
réduit.
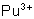 : (bleu-violet): oxydé facilement
en
: (bleu-violet): oxydé facilement
en 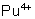 .
.
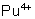 : : stable en milieu acide. Se
dismute en milieu faiblement acide en
: : stable en milieu acide. Se
dismute en milieu faiblement acide en 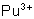 et
et 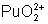 .
.
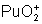 : ? : se dismute
toujours.
: ? : se dismute
toujours.
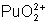 : (jaune-rose) : stable. Assez
facile à réduire.
: (jaune-rose) : stable. Assez
facile à réduire.
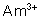 : (rose) : stable ; difficile à
oxyder.
: (rose) : stable ; difficile à
oxyder.
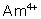 : (rose-rouge): stable en présence
d’ions fluorure 15 mole par litre (il se forme
: (rose-rouge): stable en présence
d’ions fluorure 15 mole par litre (il se forme 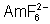 ). Est facilement
réduit, par l’ion iodure par exemple.
). Est facilement
réduit, par l’ion iodure par exemple.
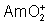 : (jaune-pâle): dismutation en
milieu acide fort.
: (jaune-pâle): dismutation en
milieu acide fort.
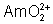 : (rhum) : est réduit rapidement
(4% par heure).
: (rhum) : est réduit rapidement
(4% par heure).
Diagramme de Frost des
Actinides.
2. Métallurgie de
l’uranium
Il est plus abondant que Hg, Ag, Cd
ou Bi, mais il est très disséminé. Le plus important de ses minerais est la
pechblende formée de divers oxydes d’uranium (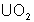 et
et 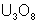 essentiellement).
Le minerai subit les traitement suivants :
essentiellement).
Le minerai subit les traitement suivants :
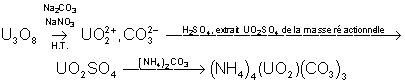
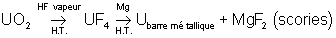
On obtient le carbonate double
d’ammonium et d’uranyle qui précipite. Il est séché et décomposé à la chaleur en
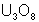 pur, puis en
pur, puis en 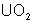 . Celui-ci est ensuite réduit grâce au passage par un fluorure
:
. Celui-ci est ensuite réduit grâce au passage par un fluorure
:
3. Séparation de
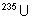 et de
et de 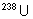 , ainsi que de Pu et de
U .
, ainsi que de Pu et de
U .
3.1.
Procédé par diffusion gazeuse.
Ce procédé utilise l’hexafluorure
d’uranium, obtenu par traitement du métal par F2 en présence d’un peu
de Cl2 (sinon on obtient UF4). UF6 est jaune
pâle, fond à 69°C sous 2 bars et se sublime à 56°C sous un bar. On peut
également l’obtenir par action de ClF3 sur l’uranium
métallique.
UF6 est stable en
présence d’air, d’oxygène, de chlore ou d’iode. Par contre il est hydrolysé en
sel d’uranyle :
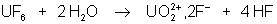
UF6 est octaédrique.  , de masses
molaires différentes, vont diffuser à une vitesse différente au travers d’une
membrane poreuse. On pourra ainsi séparer ces deux gaz. C’est
, de masses
molaires différentes, vont diffuser à une vitesse différente au travers d’une
membrane poreuse. On pourra ainsi séparer ces deux gaz. C’est 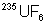 qui diffuse le
plus vite. Une fois séparé,
qui diffuse le
plus vite. Une fois séparé, 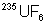 est réduit et hydrolysé en
est réduit et hydrolysé en 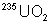 , traité comme
précédemment.
, traité comme
précédemment.
3.2.
Séparation à grande échelle du
plutonium.
On utilise une solution de phosphate
de tributyle PO(BuO)3 (TBP) dans un solvant organique. Les nitrates d’uranyle et
de plutonyle ( ) sont extraits d’une solution aqueuse d’acide nitrique par du
kérosène purifié contenant du TBP. On obtient les complexes qui
suivent.
) sont extraits d’une solution aqueuse d’acide nitrique par du
kérosène purifié contenant du TBP. On obtient les complexes qui
suivent.
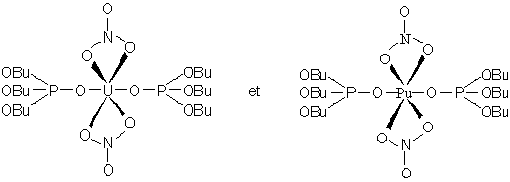
Cette solution kérosènique est lavée
avec une solution d’acide nitrique dilué contenant un agent réducteur. PuVI est
réduit facilement en PuIII (voir le diagramme de Frost). Ces sels de PuIII
passent dans l’eau, alors que le complexe d’uranyle, qui n’est pas réduit,
demeure dans le kérosène. Le lavage du kérosène par l’eau en milieu neutre
détruit le complexe précédent et l’on récupère dans l’eau du nitrate d’uranyle
seul.
4. Propriétés
chimiques de l’uranium et de ses composés.
4.1.
Oxydes.
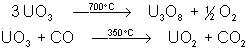 La non stœchiométrie
est très importante pour ces oxydes, et le mélange oxygène-uranium forme un
système très complexe. Par exemple, on peut ajouter jusqu’à 10% d’oxygène à UO2
sans qu’il y ait de modification notable de la structure : la phase UO2 s’étend
de UO2 à UO2,25 (brun-noir). U3O8 est vert-noir, UO3 est orangé-jaune. Celui-ci
est obtenu par décomposition à 350°C du nitrate d’uranyle. Les autres sont
obtenus de la manière suivante :
La non stœchiométrie
est très importante pour ces oxydes, et le mélange oxygène-uranium forme un
système très complexe. Par exemple, on peut ajouter jusqu’à 10% d’oxygène à UO2
sans qu’il y ait de modification notable de la structure : la phase UO2 s’étend
de UO2 à UO2,25 (brun-noir). U3O8 est vert-noir, UO3 est orangé-jaune. Celui-ci
est obtenu par décomposition à 350°C du nitrate d’uranyle. Les autres sont
obtenus de la manière suivante :
Ces oxydes se dissolvent dans
l’acide nitrique en donnant des sels d’uranyle tels que le nitrate d’uranyle
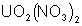 .
.
4.2.
Uranates.
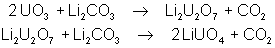 L’oxyde UO3, fondu avec
des carbonates alcalins ou alcalino-terreux, donne des composés oranges ou
jaunes appelés uranates :
L’oxyde UO3, fondu avec
des carbonates alcalins ou alcalino-terreux, donne des composés oranges ou
jaunes appelés uranates :
On constate qu’il s’agit de composés
de même structure que les chromates et bichromates, molybdates et
polymolybdates, tungstates et polytungstates.
4.3.
Halogénures.
4.3.1.
Fluorures.
UF3 est cristallin et
ressemble aux fluorures de lanthanides. UF4 est un solide vert
insoluble dans l’eau. Nous avons vu comment obtenir UF6 . C’est un
agent fluorant puissant, par exemple :
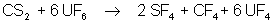
UF5 est peu stable, se dismute
rapidement. Il a une structure de polymère.
4.3.2.
Chlorures.
UCl3 (rouge) est beaucoup
plus réducteur que UF3 ; il n’est stable qu’en milieu anhydre. Il est
obtenu par la réaction suivante : 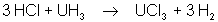 . UCl4
(vert) est le plus stable des chlorures. C’est un solide soluble dans les agents
organiques polaires. UCl5 et UCl6 sont très violemment
hydrolysés en sels d’uranyle. UCl5 se dismute.
. UCl4
(vert) est le plus stable des chlorures. C’est un solide soluble dans les agents
organiques polaires. UCl5 et UCl6 sont très violemment
hydrolysés en sels d’uranyle. UCl5 se dismute.
4.4.
Complexes halogénés.
Seuls les complexes fluorés sont
importants, par exemple ceux de UIV : 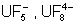 … Les plus
intéressant concerne le degré +5 qui est stabilisé dans l’acide fluorhydrique
par formation de l’acide hexafluorouraniqueV HUF6
.
… Les plus
intéressant concerne le degré +5 qui est stabilisé dans l’acide fluorhydrique
par formation de l’acide hexafluorouraniqueV HUF6
.
4.5. Sels
d’uranyle 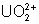
C’est le composé d’uranium le plus
stable en solution aqueuse. En général, il s’agit plutôt de complexes covalents,
car ce sont des sels solubles dans les solvants organiques polaires. Le plus
connu de ces sels d’uranyle est l’acétate d’uranyle et de zinc (sel de
Seignette) qui permet d’obtenir un précipité en présence d’acétate de sodium. Ce
précipité est un des seuls composés insoluble du sodium :
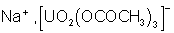
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()