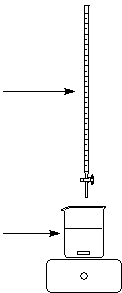
A1 : Suivi de l’avancement d’une réaction de complexation par
spectrophotométrie
|
On envisage l’addition progressive de la
solution du ligand L à une solution du cation métallique Mn+aq.
L’équation associée à la réaction est :
Mn+aq + L aq = MLn+aq
|
Solution de ligand L C = 0,050 mol.L-1 V0 mL d’une solution d’ions Mn+aq de conc. C0 |
|
1. Etude
expérimentale de l’avancement d’une réaction de complexation
Détermination de la valeur
expérimentale de l’avancement à partir de l’absorbance de la solution :
Expression de l’absorbance de la solution :
![]()
![]()
![]()
![]()
Soit
![]()
![]()
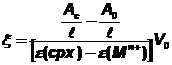
2. Résultats
expérimentaux
2.1 : Etude de la complexation des ions fer(III) par les ions thiocyanate
Fe3+ aq + SCN- aq
= [FeSCN]2+aq
·
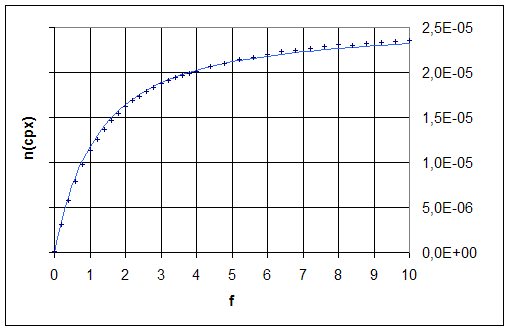
Les valeurs expérimentales de
l’avancement ksi, calculées à partir des
mesures d’absorbance, à l’aide de la
relation 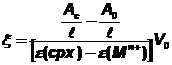 sont
représentées par des croix.
sont
représentées par des croix.
Les valeurs suivantes
de e(Fe3+)
= 4,5 mol-1.L.cm-1 et
e(FeSCN2+)
= 4,2´103
mol-1.L.cm-1
ont été utilisées (
FOSSET B., LEFROU C., MASSON A. et MINTOTAUD C. Chimie Physique expérimentale,
Hermann, 2000).
·
La courbe en trait plein correspond aux
valeurs de ksi calculées à l’aide de la relation 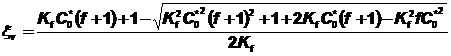 en
utilisant la valeur Kf = 4,2´102 obtenue
par minimisation la somme des carrés des différences entre les valeurs
expérimentales et calculées de ksi.
en
utilisant la valeur Kf = 4,2´102 obtenue
par minimisation la somme des carrés des différences entre les valeurs
expérimentales et calculées de ksi.
3.2 : Complexation des ions nickel(II) par l’EDTA
[Ni(H2O)6]2+
+ Y4- = [NiY]2- + 6 H2O
Compte tenu de la valeur de la constante de formation (log kf
= 18,6), l’avancement de la réaction est égal à l’avancement maximal.
Partie expérimentale : complexation des ions fer(III) par les ions thiocyanate
Solution
A : 10 mL d’une solution de thiocyanate
de potassium de conc. 1,0´10-1 mol.L-1
75 mL d’une sol. d’acide
perchlorique de conc. 0,10 mol.L-1
H2O :
qsp 250 mL
Solution
B : 10 mL d’une solution de nitrate
de fer(III) de conc. 5,0´10-2 mol.L-1
75 mL d’une sol. d’acide
perchlorique de conc. 0,10 mol.L-1
H2O :
qsp 250 mL
|
Solution A dans une burette de 50 mL 20 mL de solution B |
|
Soit
V le volume de solution de L ajouté.
Pour chaque valeur de V, mesurer l’absorbance A de la
solution à 460 nm en prélevant
quelques mL de solution dans une cuve. Après la mesure, replacer le contenu de
la cuve dans le bécher.
La
transformation est modélisée par la réaction d’équation :
Fe3+ aq + SCN- = [FeSCN]2-+
Résultats expérimentaux :
|
V |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
30 |
34 |
38 |
42 |
46 |
50 |
60 |
80 |
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac-A0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
·
Tracer la
courbe représentative de Ac-A0 en fonction de V.
·
Tracer la
courbe représentative de x en fonction de ![]() en utilisant la
valeur e([FeSCN]2-+)
= 4,2´103
mol.L-1.cm-1 à la longueur d’onde de travail (460 nm).
en utilisant la
valeur e([FeSCN]2-+)
= 4,2´103
mol.L-1.cm-1 à la longueur d’onde de travail (460 nm).
Partie expérimentale : complexation des ions nikel(II) par l’EDTA
|
Solution de sel disodique de l’EDTA C = 0,050 mol.L-1 V0 = 20 mL d’une solution
d’ions Ni2+aq C0 =
0,050 mol.L-1 |
|
Soit
V le volume de solution de L ajouté.
Pour chaque valeur de V, mesurer l’absorbance A de la
solution à 570 nm en prélevant quelques mL de solution dans une cuve. Après la
mesure, replacer le contenu de la cuve dans le bécher.
La
transformation est modélisée par la réaction d’équation :
[Ni(H2O)6]2+ + Y4-
= [NiY]2- + 6 H2O
Résultats expérimentaux :
|
V |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
38 |
30 |
35 |
40 |
45 |
50 |
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac-A0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tracer la courbe
représentative de Ac-A0 en fonction de V.
Page d'accueil Retour vers le chapitre "avancement d'une réaction de titrage" Pages chimie