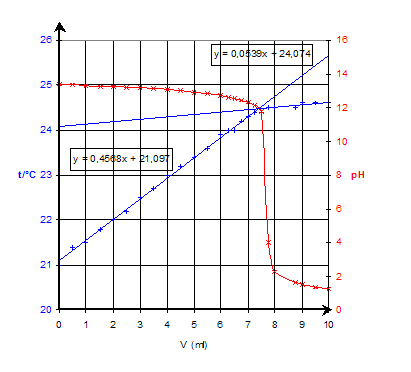
A2 : Suivi simultané de l’avancement d’une réaction acido-basique par thermométrie et par pHmétrie |
Pour une étude
complète des dosages enthalpiques, on pourra se reporter à l’article
« Dosages enthalpiques » paru dans le B.U.P N°851 (2) – Cahier enseignement supérieur.
L’étude
présentée ci-dessous est simplifiée (calorimètre parfait, pas de prise en
compte de l’enthalpie de mélange,….).
1. Etude théorique
Soit la réaction
entre deux réactifs A et B conduisant à un produit P :
Aaq + Baq = Paq
La réaction a lieu
dans un réacteur adiabatique.

Tableau d’avancement :
|
A |
B |
P |
|
CAVA |
CBVB |
|
|
CAVA - x |
CBVB - x |
x |
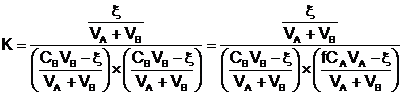
avec ![]()
Si on néglige la dilution : VA + VB-
»
VA
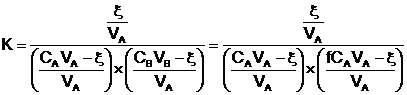
Posons : ![]() , Il vient :
, Il vient :
![]()
soit : ![]() ou
ou ![]()
Résolvons cette équation du second degré :
![]()
![]()
Dans un réacteur adiabatique (à pression constante) :
dH = 0 = CSdT
+ DrH°dx (Cs désignant la capacité thermique du
calorimètre et de son contenu)
d'où :
CSDT = -DrH´x = -DrH´VA´z
Conclusion :
|
|
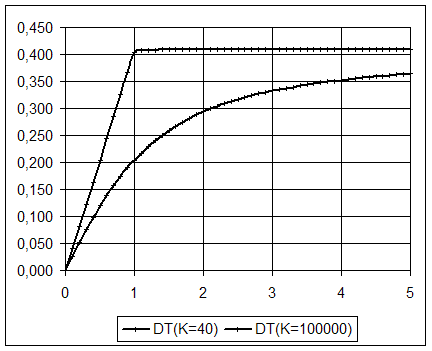
Courbes représentatives de DT en fonction de la fraction titrante f pour deux valeurs de
la constante de réaction.
Valeurs numériques
utilisées :
CA = 0,050
mol/L ; VA = 0,100 L ; CS = 465 J/K ; DrH° = -38
kJ/mol ; K = 40 et K = 1,0´ 105
2. Etude expérimentale
Suivi simultané de l’avancement d’une réaction acido-basique par thermométrie et par pH-métrie
H3O+ + HO- = 2 H2O
Montage :
une sonde résistive (thermistance) adaptée à un multimètre est utilisée pour mesurer
la température du milieu réactionnel (affichage de la température au dixième de
degré).
Un
pHmètre équipé d’une électrode combinée de faible diamètre est utilisé pour
mesurer le pH du milieu réactionnel.

3. Résultats expérimentaux
|
Réactif
titrant : acide chlorhydrique Ca=6,5
mol/L Calorimètre
: 50 mL sol hydroxyde de sodium Cb » 1 mol/L + 150 mL d'eau distillée. |
|
Page
d'accueil
Retour vers le chapitre "avancement d'une
réaction de titrage"
Pages chimie