![]() voir aussi
:
Réaction chimique et avancement
(parties théoriques et expérimentales)
voir aussi
:
Réaction chimique et avancement
(parties théoriques et expérimentales)
Une "nouveauté" pédagogique : l'avancement
|
|
1. Rappels théoriques (profs)
1.1. Notion d'avancement
Considérons la réaction de synthèse de l'ammoniac :
N2(g) + 3 H2(g) ![]() 2 NH3(g)
2 NH3(g)
Les grandeurs de réaction sont calculées à partir des tables thermodynamiques :
DrHo298
= -91,8 kJ.mol-1 (la réaction est exothermique)
DrGo298
= -33 kJ.mol-1 (la réaction est favorisée de gauche à droite)
On peut en déduire la constante d'équilibre à 298 K :
Ko(298) = exp(-DrGo298/RT
)
= 6,09.105
On pourra donc, pour ce système, envisager une
transformation totale ou, à plus haute température, une transformation
limitée (la réaction est exothermique). Notamment, la température d'inversion
pour laquelle Ko = 1 , est d'environ 200°C.
Au plan industriel, il faut trouver un compromis entre
l'aspect cinétique et l'aspect thermodynamique. On opère à 400°C, sous 300
bars, avec un catalyseur solide à base de Al2O3 , K2O
et Fe.
Le bilan de matière peut être établi en moles de la
façon suivante, à partir d'un système de proportions initiales quelconques :
|
N2(g) |
3 H2(g) |
|
2 NH3(g) |
|
|
t = 0 |
2 |
2 |
1 |
|
|
t |
2 - x |
2 – 3x |
1 + 2 x |
La variation de la quantité de chaque espèce, entre
l'instant initial et l'instant final est :
Dn(N2) = 2-x-2 = -x
Dn(H2) = 2-3x-2 = -3x
Dn(NH3) = 1+2x-1=2x
Le point commun entre toutes les espèces intervenant dans le système est le rapport entre la variation de la quantité d'une espèce et le nombre (coefficient) stœchiométrique algébrique correspondant :
![]() =
= ![]() =
= ![]() = x
= x
On pose donc, pour le système
: ![]() = x = x =avancement de la
réaction (en mol)
= x = x =avancement de la
réaction (en mol)
C'est la variable de De Donder; cette variable a donc la
dimension d'une quantité de matière. Dans le cadre du programme de seconde,
elle sera notée x.
Il est clair que dans l'exemple envisagé, l'avancement
maximum, x max, compte tenu du réactif
limitant, est de 2/3 de mole.
Le taux ou degré d'avancement
t est défini par ![]() . Il n'est pas dimensionné et représente la proportion du réactif
limitant qui s'est transformé. Dans l'exemple précédent, le bilan de matière
peut aussi s'écrire à l'aide de
. Il n'est pas dimensionné et représente la proportion du réactif
limitant qui s'est transformé. Dans l'exemple précédent, le bilan de matière
peut aussi s'écrire à l'aide de ![]() :
:
|
N2(g) |
3 H2(g) |
|
2 NH3(g) |
|
|
t = 0 |
2 |
2 |
1 |
|
|
2-x |
2-3x |
1+2x |
||
|
t |
2(1-t /3) |
2(1-t ) |
1+4t /3 |
Il est clair que le taux d'avancement maximum est de 1 dans tous les cas.
1.2. Conséquences et applications
- avancement élémentaire d'une réaction = dx = ![]() avec n i>0 pour un produit et n i<0 pour un réactif.
avec n i>0 pour un produit et n i<0 pour un réactif.
- vitesse d'une réaction = ![]() =
= ![]()
![]()
![]()
- bilan d'une réaction de dissociation d'un acide
faible :
|
AH |
+ |
H2O |
|
A- |
+ |
H3O+ |
|
0,1 |
||||||
|
0,1 - x |
x |
x |
(en négligeant l'autoprotolyse de l'eau)
On peut en déduire par exemple le pH d'une solution d'acide
méthanoïque à 0,1 mol.L-1 :
Ka = 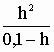 = 10-3,75 d'où h = [H3O+) =
4,13.10-3 mol.L-1 et pH = 2,4.
= 10-3,75 d'où h = [H3O+) =
4,13.10-3 mol.L-1 et pH = 2,4.
Mais on peut aussi s'intéresser au taux de dissociation de
l'acide qui, contrairement à Ka , dépend de la concentration de
l'acide :
|
AH |
+ |
H2O |
|
A- |
+ |
H3O+ |
|
c |
||||||
|
c(1-a) |
a c |
a c |
(en négligeant l'autoprotolyse de l'eau)
Le taux d'avancement n'est autre que le taux de dissociation
de l'acide et l'on a la relation : Ka= ![]() ; par ailleurs a tend vers 1 à faible concentration.
; par ailleurs a tend vers 1 à faible concentration.
Bibliographie :
Chimie Générale. R. Didier . Ed Lavoisier.
Chimie 1ère et 2ème année. Collection H prépa. Ed Hachette.
Cours de chimie 1ère et 2ème année. Collection J'intègre.Ed Dunod.
Physical Chemistry. P. W. Atkins. Ed Oxford.
2. Cadre du programme de seconde (cf doc d'accompagnement)
2.1. Définitions
- système : constitué d'espèces chimiques (T,P).
- état initial (P,T,ni) éventuellement des espèces qui ne réagissent pas.
- état final (P,T,nf) idem + espèces restantes.
- la transformation chimique est le passage de l'état initial à l'état final.
- la réaction chimique modélise la transformation chimique en indiquant la nature des réactifs, la nature des produits, ainsi que la stœchiométrie des réactifs et des produits. Son écriture symbolique est l'équation chimique. On ajuste les coefficients stœchiométriques pour rendre compte des diverses lois de conservation (éléments et charges).
2.2. Exemple de bilan de matière (exemple du document d'accompagnement)
En classe de seconde, on se contentera d’étudier des réactions rapides et totales.
Prenons l’exemple de la synthèse de l’eau (attention à l’erratum dans le BO) :
O2(g) + 2 H2(g) ----> 2H2O(g)
|
équation de la réaction |
O2(g) |
2 H2(g) |
2H2O(g) |
|
quantité de matière dans l’état initial (mol) |
7 |
5 |
0 |
|
quantité de matière au cours de la transformation (mol) |
7-x |
5-2x |
2x |
Etant donné les proportions du système initial :
Le réactif limitant est donc H2 et l’avancement final est xfinal = 2,5 mol.
L’état final du système est donc :
|
équation de la réaction |
O2(g) |
2 H2(g) |
2H2O(g) |
|
quantité de matière dans l’état initial (mol) |
7 |
5 |
0 |
|
quantité de matière au cours de la transformation (mol) |
7-x |
5-2x |
2x |
|
quantité de matière dans l’état final (mol) |
4,5 |
0 |
5 |
| C. CHONÉ |