Voici quelques expériences de chimie utilisables pour la plupart dans le cadre de l’option sciences expérimentales en première S. Certaines ont déjà été présentées lors des journées U.D.P de Metz en 97 et ont fait l’objet d’une publication (BUP avril 98)
Expériences de chimie utilisables en 1ère S
(Edith Antonot- lycée L. Vincent)
option sciences expérimentales
1. Synthèse d'un colorant azoïque et impression sur tissu par action de la lumière sur un colorant:
1.1.Source:
Préparation régionale aux Olympiades de la Chimie
1.2.Principe:
Un tissu de coton est imbibé d’une solution contenant une amine aromatique
(primuline ; commercialisée chez Aldrich). Il est ensuite traité par le
nitrite de sodium en milieu acide . Il se forme alors un sel de diazonium.
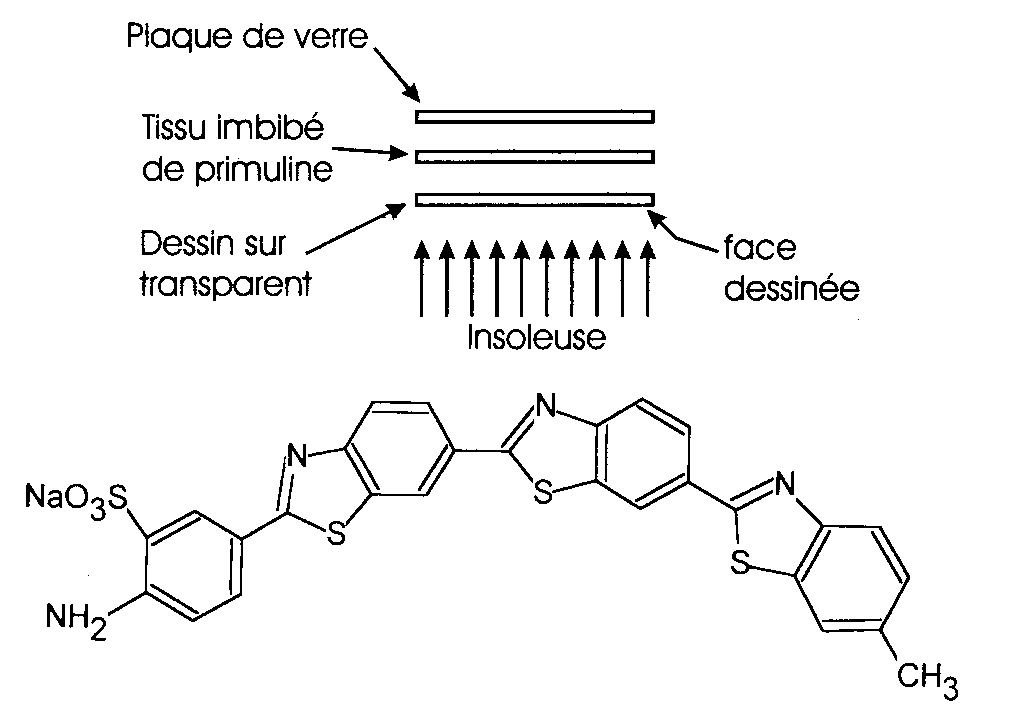
Le morceau de tissu est ensuite placé entre un transparent et une plaque de verre.
Cette plaque de verre est placée au-dessus du tissu pour le maintenir à plat. Le
transparent comporte un dessin fait au feutre noir bien opaque. L'ensemble est placé sur
une insoleuse et on l'éclairera pendant 20 minutes environ (durée dépendant de la lampe
utilisée).
L'éclairement intense provoque la décomposition de ce sel de diazonium partout où la lumière arrive, mais pas sous le masque noir.

On peut alors procéder à l'étape de copulation de ce sel de diazonium non détruit avec du b-naphtol et on peut ainsi obtenir une image ou un texte de la couleur du colorant azoïque formé sur le tissu.
1.3.Mode opératoire:
(pour un échantillon de tissu d’environ 8 x10 cm, de masse environ 1 g)
Etape 1: coloration du tissu
Prélever 40 mL de solution de primuline à 500 mg/L, les placer dans un bécher de 250 mL puis compléter à 100 mL avec de l'eau et ajouter 1 gramme de chlorure de sodium. Placer l’échantillon de tissu dans le bécher. Porter à ébullition 15 minutes. Retirer le tissu du bécher, le rincer et l'essorer sommairement.
Etape 2: Diazotation
Mettre dans un bécher, 50 mL de solution à 5 grammes par litre de nitrite de sodium
NaNO2 et 50 mL de solution d'acide chlorhydrique à 0,1 mol/L. Refroidir la solution
obtenue en dessous de 10°C (bain de glace).
Placer le morceau de tissu dans la solution.
Observer la "montée" de la couleur. Laisser dans le bain 15 minutes.
Rincer rapidement à l'eau froide et retremper le tissu dans environ 50 mL d'une
solution d'acide chlorhydrique à 0,05 mol/L. Essorer sommairement.
Etape 3:Insolation
Placer le transparent sur l'insoleuse, puis le tissu, puis la plaque de verre. La durée d'insolation est de 20 minutes environ (à régler en fonction de la lampe utilisée).
Etape 4: Réaction de copulation
Mettre le tissu dans un bécher contenant 50 mL de solution à 12 grammes par litre de
b-naphtol en milieu soude à 0,1 mol/L.
La réaction de copulation est rapide; retirer le tissu au bout de une ou deux minutes,
le rincer puis le sécher entre deux feuilles de papier filtre.
2. Quelques expériences sur les complexes du cobalt(II):
2.1. Source :
En partie Université d’Eté de Chimie " Chimie et
Lumière "1993
2.2. Présentation de différents complexes :
Dans 3 tubes à essais, placer un peu de solution de chlorure de cobalt (II) à 0,1
mol/L (environ 1 cm de haut). Noter la couleur.
Ajouter:
· dans le tube 1: de l'acide chlorhydrique concentré à l'aide d'un compte gouttes ou d'une pipette. Noter la couleur observée.
· dans le tube 2: un peu de solution de thiocyanate de potassium (ou sulfocyanure de potassium)( K++ SCN-). Noter la couleur observée.
· dans le tube 3: un peu de solution de potasse (hydroxyde de potassium) concentrée si possible au fond du tube. Noter la couleur observée.
Sachant qu'en solution aqueuse le cobalt (II) est sous forme d'ions complexes Co(H2O)62+, répondre aux questions suivantes:
· quelles sont les couleurs des complexes suivants: Co(H2O)62+ Co(SCN)42- CoCl42- Co(OH)3- Co(OH)2
· classer par stabilité croissante: Co(H2O)62+ et Co(SCN)42- Co(H2O)62+ et CoCl42-
Reprendre le tube 1 et rajouter de l'eau. Que constate-t-on, comment peut-on interpréter ce phénomène.
2.3 . Thermomètre au cobalt:
Principe:
La couleur des complexes du cobalt(II) est fonction de la nature du ligand: roses en solution aqueuse, ils sont rouges dans le méthanol, bleu dans l'éthanol. En variant les proportions de ces solvants, on peut ainsi obtenir toute une gamme de teintes et provoquer le passage de l'une à l'autre par variation de température.
Expérience
Une solution de chlorure de cobalt en milieu eau-alcool est préparée ainsi: on
dissout 0,8 g de chlorure de cobalt CoCl2, 6 H2O dans 45 mL d'éthanol à 95% et on ajoute
8 gouttes d'eau.
Prélever 2 mL de cette solution dans un tube à essais. Noter sa couleur.
Refroidir le mélange en dessous de 15°C puis laisser réchauffer à température
ambiante et enfin doucement au bain-marie tiède (30°C environ). Refroidir de nouveau
progressivement. Noter les teintes du "thermomètre" obtenu en fonction de la
température.
Quelle est l'influence de la température sur l'équilibre:
Co(H2O)62+ + 2 Cl- + 2 C2H5OH ![]() Co(C2H5OH)2Cl2 + 6 H2O
Co(C2H5OH)2Cl2 + 6 H2O
2.4. Encre sympathique:
Sur un papier filtre, déposer quelques gouttes de solution de chlorure de cobalt (à
environ 0,1 mol/L) .
Placer la feuille sur une plaque chauffante tiède et observer le changement de
couleur. Noter ce changement de couleur. Interprétez le.
3. Etude de colorants alimentaires par chromatographie sur papier:
3.1. Source :
Journal of Chemical Education, décembre 92
3.2. Expérience:
Les colorants alimentaires sont des additifs alimentaires qui ont un numéro de code C.E.E de 100 à 199 précédé de la lettre E. Les formules de ces colorants, leurs utilisation ainsi que la D.J.A (dose journalière admissible exprimée en mg/kg de poids corporel mg/kg p.c) figurent dans l’ouvrage de N. et M.MOLL " Additifs alimentaires et auxiliaires technologiques " aux Editions Masson.
On dispose tout d'abord d'un lot de trois colorants alimentaires commercialisés sous la marque Vahiné:
· colorant jaune:E 102, tartrazine
· colorant rouge: E 122, azorubine
· colorant vert: mélange de tartrazine (Jaune, E 102) et de Bleu Patenté V (Bleu E 131)
D'autre part, on dispose de bonbons chocolatés "M
&
M's" contenant les colorants E 104, E 110, E 122, E 124, E 131, E 171.
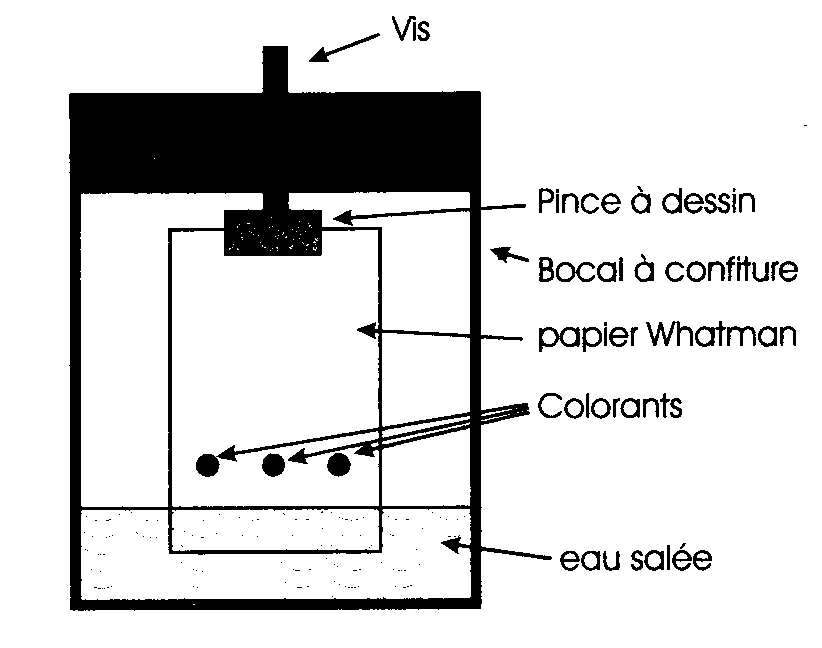
On découpera une bande de papier Whatman (papier utilisé pour la chromatographie) de
hauteur telle qu'elle tienne comme indiqué dans le bocal.
A 2 cm du bord inférieur du papier Whatman, on placera à un centimètre l'une de
l'autre au minimum les taches demandées à l'aide de cure-dents un peu émoussés, en
commençant à environ 1 cm du bord.
Pour les bonbons, on procèdera ainsi: à l'aide d'un cure-dent que l'on mouillera, on
grattera le bonbon de la couleur choisie pour extraire le colorant. Il faut faire
attention à ne pas atteindre le chocolat. L'extrait est appliqué d'un mouvement rapide
à sa place prévue sur le papier Whatman.
On pourra faire 3 ou 4 applications successives au même endroit pour avoir une tache
bien colorée en séchant éventuellement au sèche -cheveux pour éviter l'étalement
entre chaque dépôt, alors que pour les colorants Vahiné un seul dépôt est suffisant.
Sécher la bande de papier Whatman au sèche-cheveux , puis placez-la comme indiqué
avec la pince à dessin dans un bocal où vous aurez versé auparavant 1 cm environ de
solution de chlorure de sodium à 0,1% en masse.
Observez la migration jusqu'à ce que le solvant arrive à 2 cm du haut du papier
Whatman environ.
Noter rapidement au crayon de papier les positions du solvant (front du solvant) et de
chaque tache. Séchez la feuille de papier Whatman rapidement au sèche-cheveux.
Mesurer les Rf de chaque constituant. Pour les taches étalées, on prendra le milieu
de la tache.
4. Isomérisation de l'azobenzène:
4.1. Source :
Cette expérience permet d’illustrer le principe de la vision (isomérisation Z-E
du rétinal)
L'azobenzène (C6H5-N=N-C6H5) est
commercialisé par exemple chez Aldrich sous forme de l'isomère E. Sous l'action de la
lumière, il se transforme en l'isomère Z.
Cette réaction sera étudiée par chromatographie sur couche mince (C.C.M).
La phase stationnaire est constituée de silice fixée sur une plaque de verre.
L'éluant (ou phase mobile) utilisé sera du toluène.
On prépare 2 solutions contenant chacune 0,2 g d'azobenzène dans 8 mL de toluène.
Une des solutions est placée dans un tube à essais placé à l'obscurité.
Tracer un trait au crayon de papier à 1 cm du bord inférieur de la plaque de silice
et placer sur cette ligne 2 croix à 2 cm des bords environ.
A l'aide d'un capillaire, déposer une goutte de la solution d'azobenzène dans le
toluène sur une des croix. On peut faire deux dépôts au même endoit, en séchant au
sèche-cheveux entre les deux dépôts. La tache ne doit pas dépasser 3 à 4 mm de
diamètre.
Eclairer la plaque à l'aide d'une lampe de bureau pendant un peu moins d’une
heure.
Préparer la cuve de chromatographie en mettant 0,5 cm de haut de toluène dans une
cuve chromatographique et fermer la cuve (la cuve doit être saturée en vapeurs de
solvant).
Pour que la saturation et l'élution soient plus rapides, on pourra placer une bande de
papier filtre contre les parois de la cuve chromatographique.
Au bout d'une heure d'éclairement de la plaque, déposer sur l'autre croix un ou deux
dépôts de la solution d'azobenzène maintenue à l'obscurité.
Eluer au toluène.
Lorsque le front du solvant est à quelques cm du haut de la plaque, sortir la plaque
de la cuve, marquer rapidement la position du front de l'éluant, sécher la plaque au
sèche-cheveux et mesurer les Rf des isomères E et Z de l'azobenzène.
5. Séparation des colorants d'un sirop de menthe:
5.1. Source :
" Séparation des colorants d'un sirop de menthe par chromatographie" (BUP
n° 756 Juillet-août-septembre 93)
Préparation de la colonne:
Placer un petit morceau de coton au fond d'une pipette de Pasteur. Verser une spatule de silice dans de l'eau. Mettre en suspension, puis verser dans la pipette Pasteur maintenue verticale.
Elution:
Dès que le niveau d'eau atteint le lit de la colonne, déposer à l'aide d'un
compte-gouttes deux gouttes de sirop de menthe, puis maintenir immédiatement la colonne
pleine d'eau à ras bord.
Le premier colorant est élué à l'eau: il s'agit de la tartrazine. On peut tracer son
spectre.
Eluer le second colorant à l'aide d'éthanol à 95%: il s'agit de bleu Patenté V; on
pourra également tracer son spectre.
On peut comparer ces spectres avec les spectres des colorants Vahiné:
colorant jaune (tartrazine)
colorant vert (mélange de tartrazine et de bleu patenté V)
On pourra également tracer le spectre d'une solution aqueuse de sirop de menthe.
6. Chromatographie sur T-shirt
6 .1. Source :
Journal of Chemical Education Décembre 92
6.2. Expérience :
L'exemple qui suit est une chromatographie radiale que l'on fera de préférence sous la hotte à cause des solvants utilisés:
· Tendre sur un cristallisoir d'environ 15 cm de diamètre, un morceau de tissu de coton blanc. Le maintenir tendu à l'aide d'un élastique ou de ficelle.
· Repérer le centre du cercle formé par le tissu.
· Placer 4 à 6 taches de feutres permanents sur la circonférence d'un cercle imaginaire, environ quatre fois plus petit que le cristallisoir.
· A l'aide d'un compte-gouttes, appliquer l'éluant (propan-2-ol/eau en proportions volumiques 7/3) au centre du cercle de telle sorte que l'éluant mouille le tissu et se déplace radialement vers les bords en créant un chromatogramme.
· Quand le motif a atteint la taille voulue, arrêter les ajouts d'éluant et laisser sécher le tissu environ 10 min sous la hotte.
7. Etude d’un équilibre ou l’œuf sur le plat :
7.1. Source :
Journal of Chemical Education, mars 1997
7.2. Expérience :
Cette expérience n’est pas utilisable en 1èreS, mais permet de mettre
en évidence la notion d’équilibre chimique.
Dans une boîte de Pétri, on place des cristaux d’iodure de potassium de
différentes tailles et on ajoute une goutte d’une solution de nitrate de plomb à
0,1 mol/L sur chaque cristal. On observe des aiguilles jaunes de PbI2 si le
cristal est petit, un cœur de PbI2 entouré d’aiguilles blanches de
KPbI3 (type œuf sur le plat) pour un cristal de taille moyenne, uniquement
KPbI3 pour les plus gros cristaux ou une solution claire contenant des
complexes PbIn(n-2)-.
2 K+ + 2 I- + Pb2+ PbI2(s) + 2 K+ (1) PbI2(s) + K+ + I- KPbI3(s) (2)
La solubilité de KI est suffisante pour dissoudre de relativement gros cristaux dans
une seule goutte de solution de Pb(NO3)2. Cependant la présence de
forte concentration de KI déplace les équilibres vers la droite. Si le cristal
n’est pas assez gros, on observe un mélange de PbI2 et KPbI3
et avec un petit, seule la première réaction est possible.
Dans le cas où le mélange des 2 solides est en équilibre avec l’iodure de
potassium dissous, il est possible de déplacer l’équilibre, d’après la loi de
Le Chatelier :