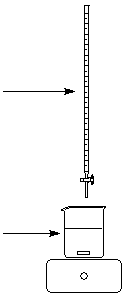
A1 : Suivi de l�avancement d�une r�action de complexation par
spectrophotom�trie
|
On envisage l�addition progressive de la
solution du ligand L � une solution du cation m�tallique Mn+aq.
L��quation associ�e � la r�action est :
Mn+aq + L aq = MLn+aq
|
Solution de ligand L C = 0,050 mol.L-1 V0� mL d�une solution d�ions Mn+aq� de conc. C0 |
|
1. Etude
exp�rimentale de l�avancement d�une r�action de complexation
D�termination de la valeur
exp�rimentale de l�avancement � partir de l�absorbance de la solution :
Expression de l�absorbance de la solution :
![]()
![]()
![]()
![]()
Soit
![]()
![]()
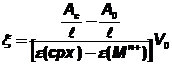
2. R�sultats
exp�rimentaux
2.1 : Etude de la complexation des ions fer(III) par les ions thiocyanate
Fe3+ aq + SCN- aq
= [FeSCN]2+aq
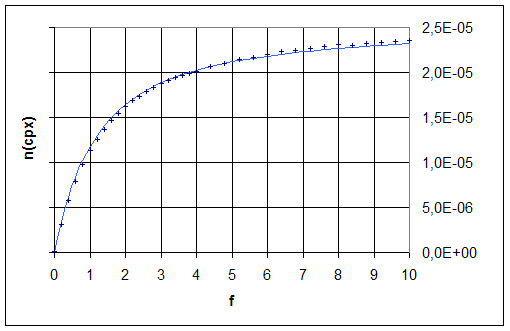
�
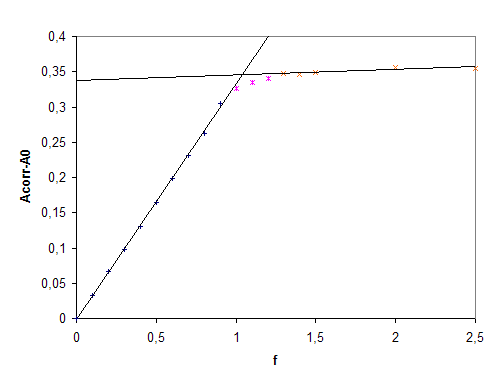
Les valeurs exp�rimentales de
l�avancement� ksi, calcul�es � partir des
mesures d�absorbance, �� l�aide de la
relation 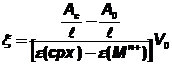 �sont
repr�sent�es par des croix.
�sont
repr�sent�es par des croix.
Les valeurs suivantes
de e(Fe3+)
= 4,5 mol-1.L.cm-1 et
e(FeSCN2+)
= 4,2�103
mol-1.L.cm-1
ont �t� utilis�es (
FOSSET B., LEFROU C., MASSON A. et MINTOTAUD C. Chimie Physique exp�rimentale,
Hermann, 2000).
�
La courbe en trait plein correspond aux
valeurs de ksi calcul�es � l�aide de la relation 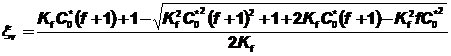 �en
utilisant la valeur Kf = 4,2�102� obtenue
par minimisation la somme des carr�s des diff�rences entre les valeurs
exp�rimentales et calcul�es de ksi.
�en
utilisant la valeur Kf = 4,2�102� obtenue
par minimisation la somme des carr�s des diff�rences entre les valeurs
exp�rimentales et calcul�es de ksi.
3.2 : Complexation des ions nickel(II) par l�EDTA
[Ni(H2O)6]2+
+ Y4- = [NiY]2- + 6 H2O
Compte tenu de la� valeur de la constante de formation (log kf
= 18,6), l�avancement de la r�action est �gal � l�avancement maximal.
Partie exp�rimentale : complexation des ions fer(III) par les ions thiocyanate
Solution
A : � 10 mL d�une solution de thiocyanate
de potassium de conc. 1,0�10-1 mol.L-1
����������������������� 75 mL d�une sol. d�acide
perchlorique de conc. 0,10 mol.L-1
����������������������� H2O :
qsp 250 mL
Solution
B : � 10 mL d�une solution de nitrate
de fer(III) de conc. 5,0�10-2 mol.L-1
����������������������� 75 mL d�une sol. d�acide
perchlorique de conc. 0,10 mol.L-1
����������������������� H2O :
qsp 250 mL
|
Solution A dans une burette de 50 mL 20 mL de solution B |
|
Soit
V le volume de solution de L ajout�.
Pour chaque valeur de V, mesurer l�absorbance A de la
solution � 460 nm en pr�levant
quelques mL de solution dans une cuve. Apr�s la mesure, replacer le contenu de
la cuve dans le b�cher.
La
transformation est mod�lis�e par la r�action d��quation :
Fe3+ aq + SCN- = [FeSCN]2-+
R�sultats exp�rimentaux :
|
V |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
30 |
34 |
38 |
42 |
46 |
50 |
60 |
80 |
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac-A0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
�
Tracer la
courbe repr�sentative de Ac-A0 en fonction de V.
�
Tracer la
courbe repr�sentative de x en fonction de ![]() en utilisant la
valeur e([FeSCN]2-+)
= 4,2�103
mol.L-1.cm-1 � la longueur d�onde de travail (460 nm).
en utilisant la
valeur e([FeSCN]2-+)
= 4,2�103
mol.L-1.cm-1 � la longueur d�onde de travail (460 nm).
Partie exp�rimentale : complexation des ions nikel(II) par l�EDTA
|
Solution de sel disodique de l�EDTA C = 0,050 mol.L-1 V0 = 20 mL d�une solution
d�ions Ni2+aq C0 =
0,050 mol.L-1 |
|
Soit
V le volume de solution de L ajout�.
Pour chaque valeur de V, mesurer l�absorbance A de la
solution � 570 nm en pr�levant quelques mL de solution dans une cuve. Apr�s la
mesure, replacer le contenu de la cuve dans le b�cher.
La
transformation est mod�lis�e par la r�action d��quation :
[Ni(H2O)6]2+ + Y4-
= [NiY]2- + 6 H2O
R�sultats exp�rimentaux :
|
V |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
38 |
30 |
35 |
40 |
45 |
50 |
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ac-A0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tracer la courbe
repr�sentative de Ac-A0 en fonction de V.
Page d'accueil Retour vers le chapitre "avancement d'une r�action de titrage" Pages chimie