|
|
Sommaire :
1. Oxydo-r�duction n�1: Exp�rience de la bouteille bleue
Bibliographie :
" L�oxydor�duction, concepts et exp�riences " Auteurs : Sarrazin et Verdaguer Editeur :ellipses
Exp�rience:
Placer 50 mL de solution de potasse dans un erlen de 100 mL
muni d'un bouchon. Ajouter 1 gramme de glucose puis 1 � 1,5 mL de solution de
bleu de m�thyl�ne. Homog�n�iser et boucher l'erlen. La solution initialement
bleue devient rapidement incolore (en quelques dizaines de secondes au maximum).
Agiter le flacon: la solution devient bleue puis se d�colore lentement. On peut
recommencer le cycle jusqu'� �puisement de l'atmosph�re au-dessus de la
solution si le flacon est bouch� ou jusqu'� �puisement du glucose. La
solution devient progressivement jaun�tre.
.Explications:
C'est une r�action d'oxydation du glucose par l'oxyg�ne
dissous catalys�e par les ions HO- et le bleu de m�thyl�ne. Le bleu de
m�thyl�ne sert aussi d'indicateur redox: sa forme oxyd�e est bleue, sa forme
r�duite incolore.
Lorsqu'on agite le flacon, l'oxyg�ne dissous oxyde le bleu de m�thyl�ne
"en bleu" jusqu'� �puisement de l'oxyg�ne dissous; il y a alors
d�coloration.
Mati�re d��uvre :
2. Oxydo-r�duction n� 2 : Exp�rience de la bouteille multicolore:
Bibliographie :
" L�oxydor�duction, concepts et exp�riences " Auteurs : Sarrazin et Verdaguer Editeur :ellipses
Exp�rience:
Dans un petit erlen de 100 mL, m�langer 10 mL de solution A
de potasse et 10 mL de solution B de glucose. Ajouter 1,5 mL de la solution C de
benzo�ne et 1,2 mL de la solution D de carmin d�indigo. Le carmin d'indigo,
d'abord bleu, devient vert imm�diatement. Boucher le flacon.
Apr�s une courte p�riode d'induction, la solution devient violette, rouge,
orange et en derni�re instance, jaune. On revient directement � la coloration
verte en agitant vigoureusement le flacon. On revient progressivement au vert en
passant par toutes les couleurs, dans l'ordre inverse, en secouant le flacon
d'abord doucement, puis de plus en plus vigoureusement. On peut recommencer
l'exp�rience plusieurs fois. Quand la couleur verte s'att�nue, on peut ajouter
de la solution D si l'on souhaite continuer l'exp�rience.
Explications:
L'interpr�tation est fondamentalement la m�me que pour
l'exp�rience pr�c�dente: le carmin d'indigo dont la forme oxyd�e
IndOx est verte en milieu basique est � la fois indicateur d'oxydo-r�duction
et catalyseur. Il est r�duit par le glucose et sa forme r�duite
IndR est de couleur jaune. L'oxyg�ne de l'air, qui se dissout lorsque l'on
agite le flacon, oxyde la forme r�duite jaune du carmin d'indigo en forme
oxyd�e verte.
Il est probable que la couleur violette soit due � un produit d'oxydation de
la benzo�ne.
En outre, celle-ci acc�l�re la r�action qui se produit en son absence
mais plus lentement.
Mati�re d��uvre :
Solution A: solution de potasse (4 g de potasse pour 150 mL
d'eau)
Solution B: solution de glucose (5 g de glucose dans 150 mL d'eau)
Solution C: solution de benzo�ne (0,1 g de benzo�ne dans 100 mL de m�thanol)
Solution D: solution de carmin d'indigo (0,5 g de carmin d'indigo dans 100 mL
d'eau)
3. Oxydo-r�duction n� 3 : r�action chronom�tre :
Bibliographie :
Pr�paration aux Olympiades de chimie Nancy-Metz 1995 : T.P " Magie chimique "
Exp�rience :
Placer dans 2 erlens diff�rents :
Vider l�erlen A dans B en agitant rapidement. Apr�s un peu d�attente, une coloration bleue fonc�e doit appara�tre et dispara�tre ensuite.
Explications :
L�iode (coloration bleue fonc�e en pr�sence d�empois d�amidon) peut se former par une r�action lente entre les ions iodate IO3- et hydrog�nosulfite HSO3- :
2 IO3-+ 2 H++ 5 HSO3- � I2+ H2O + 5 HSO4-
L�iode form�e peut dispara�tre par une r�action rapide avec HSO3- :
I2 + HSO3- + H2O � 2 I- + 2 H+ + HSO4-
L�iode peut �galement dispara�tre par une r�action lente avec l�acide malonique
HOOC-CH2-COOH + I2 � I- + HOOC-CHI-COOH + H+
L�iode qui se forme est d�abord d�truit par l�ion
hydrog�nosulfite HSO3- : pas de couleur.
Ensuite l�iode se trouve en exc�s quand il n�y a plus de HSO3- :
coloration bleue fonc�e.
Puis l�iode dispara�t par r�action avec l�acide malonique : d�coloration.
Dans ces r�actions chronom�tres, l��tat de propret� de la verrerie, l�homog�n�isation
des solutions sont des param�tres importants.
Mati�re d��uvre :
Bibliographie :
" Chimie des couleurs et des odeurs " Auteurs : Capon, Courilleau, Valette Editeur : Cultures et Techniques (Nantes)
Explications:
La chromatographie est une m�thode physique de s�paration
bas�e sur les diff�rences d'affinit�s des substances � analyser � l'�gard
de deux phases, l'une stationnaire ou fixe, l'autre mobile.
Selon la technique chromatographique mise en jeu, la s�paration des composants
entra�n�s par la phase mobile, r�sulte soit de leur adsorption et de
leur d�sorption successives sur la phase stationnaire, soit de leur solubilit�
diff�rente dans chaque phase.
On d�finit un coefficient de partition K:
K = masse de solut� dans la phase stationnaire par unit� de volume /masse de solut� dans la phase mobile par unit� de volume
En chromatographie sur couche mince, chaque constituant d'un m�lange a une affinit� propre pour l'adsorbant (la silice) et pour l'�luant, il va donc progresser avec une vitesse qui lui est propre. Chaque constituant est caract�ris� par son Rf
Rf= distance parcourue par le constituant : distance parcourue par l'�luant
On peut ainsi s�parer les constituants d'un m�lange
S�paration des pigments du paprika par CCM et mati�re d�oeuvre:
On a plac� dans un ballon de 100 mL, 2 grammes de paprika
commercial et 20 mL de dichlorom�thane. Apr�s chauffage � reflux pendant 30
minutes puis filtration, la solution obtenue renferme tous les pigments du
paprika qui ont �t� extraits par le dichlorom�thane.
Proc�der � la CCM (3 d�p�ts sur la m�me plaque)
Adsorbant : gel de silice
Eluant : dichlorom�thane
R�v�lateur: inutile, les pigments apparaissent sous forme de taches color�es
que l'on peut facilement identifier.
Le paprika contient de nombreux pigments color�s qui sont facilement s�par�s
par chromatographie. Par CCM, on obtient une large tache rouge repr�sentant le
pigment majoritaire qui donne au paprika sa couleur rouge sombre. Il est
constitu� d'un m�lange d'esters d'acides gras de la capsanthine.
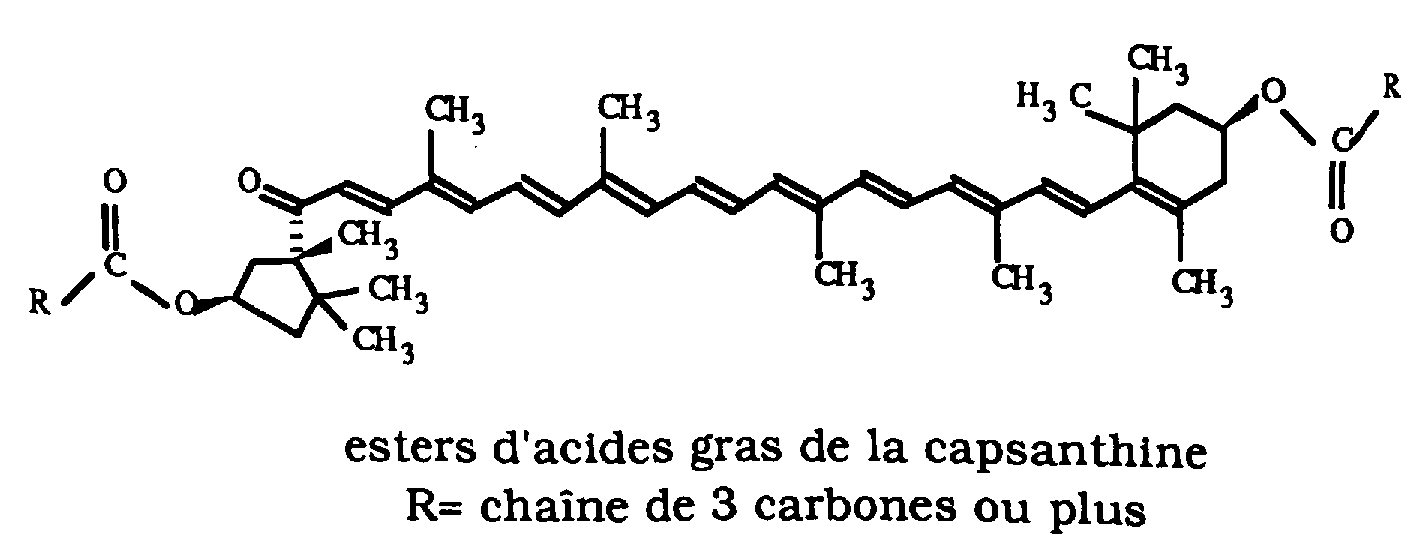
Le paprika contient d'autres carot�no�des que la capsanthine, en particulier:
� des esters d'acides gras de la capsorbine
� du b-carot�ne:
5.Chromatographie n� 2 : chromatographie sur tissu:
Bibliographie :
Journal of Chemical Education d�cembre 1992
Exp�rience et mati�re d��uvre :
L'exemple qui suit est une chromatographie radiale que
l'on fera de pr�f�rence sous la hotte � cause des solvants utilis�s:
Tendre sur un cristallisoir d'environ 15 cm de diam�tre, un morceau de tissu de
coton blanc. Le maintenir tendu � l'aide d'un bracelet �lastique.
Rep�rer le centre du cercle form� par le tissu.
Placer 4 � 6 taches de feutres permanents sur la circonf�rence d'un cercle
imaginaire, environ quatre fois plus petit que le cristallisoir.
A l'aide d'un compte-gouttes, appliquer l'�luant (propan-2-ol/eau en
proportions volumiques 7/3) au centre du cercle de telle sorte que l'�luant
mouille le tissu et se d�place radialement vers les bords en cr�ant un
chromatogramme.
Quand le motif a atteint la taille voulue, arr�ter les ajouts d'�luant et
laisser s�cher le tissu environ 10 min sous la hotte.
Pour certains feutres, on pourra constater que les couleurs observ�es sont
obtenues par m�lange de diff�rents colorants.
6. Exp�rience sur les polym�res n�1 : synth�se du nylon 6-6
Bibliographie :
" Enseigner la chimie organique au lyc�e " Auteurs : C�mente, Durupthy A et O. Editeur : Scodel (cet ouvrage n�est plus �dit�)
Principe:
Les monom�res sont
Les cha�nes form�es auront pour formule:
� NH� (CH2)6� NH� CO� (CH2)4� CO� NH� (CH2)6� NH� et sont li�es entre elles par des ponts hydrog�ne.
Mode op�ratoire et mati�re d�ouvre:
Les solution utilis�es sont du chlorure d'adipyle en
solution � 5% dans le t�trachlorure de carbone et de l'hexam�thyl�ne diamine
� 5% dans de l'eau.
Mettre 2 � 3 mL de solution de chlorure d'adipyle dans un petit b�cher;
ajouter tr�s lentement un volume �gal de solution d'hexam�thyl�ne diamine en
�vitant le m�lange. Avec un petit crochet, tirer une fibre de l'interface: on
peut enrouler de longues fibres de nylon.
On peut �ventuellement rajouter un peu de ph�nolphtal�ine qui colorera en
rose la phase aqueuse
7. Exp�rience sur les polym�res n� 2 et colorants naturels : mise en �vidence de la r�ticulation des cha�nes et boules cam�l�ons
Bibliographie :
Journal of Chemical Education
Pr�sentation des alginates :
L�alginate de sodium, extrait des algues s�ch�es est un
g�lifiant et �paississant utilis� sous la d�signation E 401 dans la
pr�paration de laits g�lifi�s et chocolat�s, cr�mes, cr�mes l�g�res sous
pression, confiserie, p�tisserie, gommes � m�cher etc..
C�est un polysaccharide (M # 240 000 g/mol). En pr�sence de cations divalents
comme les ions calcium Ca2+, il y a r�ticulation de cha�ne et
obtention de billes ou de serpentins g�latineux qui disparaissent en pr�sence
d�un exc�s d�ions sodium.
Exp�rience de r�ticulation des cha�nes :
Vous disposez d�une solution d�alginate de sodium et d�une
solution de chlorure de calcium.
Placer 10 mL de solution de chlorure de calcium dans un b�cher et verser
en un fin filet (compte gouttes) 10 mL de solution d'�alginate de
sodium (volumes mesur�s � l��prouvette gradu�e).
Observer les billes ou serpentins g�latineux qui se forment par
r�ticulation.
Pr�lever quelques billes et les verser dans un tube � essais contenant une
solution satur�e de chlorure de sodium : boucher avec un bouchon, agiter
et faire observer la disparition des billes g�latineuses en pr�sence d�un
exc�s d�ions sodium
Les boules cam�l�ons :
Principe :
On pr�pare des petites boules d�alginate de sodium impr�gn�es de solution contenant des anthocyanes (extrait de chou rouge ou de raisin). Ces anthocyanes sont des indicateurs acido-basiques : leur couleur passe du rose en milieu acide � une teinte jaune en milieu basique.
Extraction des anthocyanes:
100 g de feuilles de chou rouge (ou de grains de raisins, ou de feuilles d�azal�e) sont mis � bouillir dans 400 mL d�eau pendant 10 minutes puis refroidis � temp�rature ambiante. On obtient une coloration violette apr�s filtration � travers un papier filtre.
Pr�paration des boules cam�l�ons (pr�par�es � l�avance) :
On m�lange 10 mL de solution � 2% d�alginate de sodium et 15 mL de solution d�anthocyanes. On ajoute ce m�lange goutte � goutte � 50 mL d�une solution aqueuse de chlorure de calcium � 1% � temp�rature ambiante en maintenant une agitation magn�tique mod�r�e. Des petites boules se forment. On les conserve � environ 4�c pendant une nuit avant utilisation pour am�liorer leur r�sistance.
Exp�rience (les couleurs indiqu�es correspondent au chou rouge) :
Placer plusieurs boules dans un tube � essais contenant un peu d�eau d�min�ralis�e et quelques gouttes d�acide chlorhydrique � 0,1 mol/L : les billes pr�sentent une couleur rouge. Ajouter goutte � goutte de la soude � 0,1 mol/L pour rendre le milieu basique : la couleur des boules vire au bleu puis au jaune orange.
Apr�s 5 minutes � pH= 13, la solution est acidifi�e par addition d�acide chlrhydrique � 0,1 mol/L. Les boules virent du jaune orang� au bleu et apr�s au rouge clair. Cette op�ration est r�p�t�e jusqu�� ce que les boules se brisent.
|
� pH 1 |
� pH 7 |
� pH 13 |
R�p�table |
|
|
Raisin (peau) |
rose |
violet |
jaune-vert |
5 � 8 fois |
|
Chou rouge |
rouge |
bleu |
jaune-orange |
5 � 8 fois |
|
Azal�e (fleur) |
rouge violet |
rose |
jaune |
4 � 5 fois |
Mati�re d��uvre :
8. Extraction de la caf�ine du th�:
Bibliographie :
" Chimie organique exp�rimentale " Auteurs : Chavanne, Julien, Beaudoin, Flamand Editeur : Belin
Exp�rience et mati�re d��uvre :
Placer dans un extracteur soxhlet 300 mL d'eau + 30 g de
feuilles de th� + 15 g de carbonate de calcium dans une cartouche. Apr�s une
dizaine de cycles d'extraction, placer le liquide dans une ampoule � d�canter
et extraire la phase aqueuse avec 3 fois 40 mL de dichlorom�thane.
S�cher sur sulfate de magn�sium anhydre.
Evaporer � l'�vaporateur rotatif.
On peut recristalliser la caf�ine dans un m�lange propanone- �ther de
p�trole: dissoudre le solide dans 10 mL de propanone chaude; ajouter de
l'�ther de p�trole jusqu'� persistance du trouble. R�chauffer pour dissoudre
� nouveau. Refroidir dans la glace; filtrer sur b�chner: on r�cup�re environ
0,5 g de caf�ine et on peut prendre son point de fusion.(TF= 234 �
236,5 �C)
Des agents de saveurs comme la chlorophylle et des tannins sont entra�n�s en
m�me temps que l'eau mais l'addition de carbonate de calcium les transforme en
sels insolubles �limin�s par filtration. La caf�ine et la chlorophylle sont
extraites de la solution par le dichlorom�thane.
La purification est r�alis�e par recristallisation.
9. Isolement de l'huile de clou de girofle par entra�nement � la vapeur:
Installer le g�n�rateur de vapeur.
Placer dans un tricol de 500 ml: 30 g de clou de girofle moulu et 150 mL d'eau.
R�aliser un entra�nement � la vapeur puis recueillir le distillat et le
transvaser dans une ampoule � d�canter.
Extraire avec 3 fois 20 mL de dichlorom�thane. Recueillir les phases
organiques. S�cher sur sulfate de magn�sium anhydre.
Eliminer le dichlorom�thane � l'�vaporateur rotatif.
Le principal constituant de l'huile obtenue est de l'eug�nol
(2-m�thoxy,6-allyl, ph�nol)
Les huiles essentielles, dont l'huile de clou de girofle sont un m�lange de
compos�s organiques peu solubles dans l'eau qui conf�rent aux plantes leur
odeur. Pour cette raison, elles sont employ�es comme ingr�dients en parfumerie
ou comme agents de saveur dans l'alimentation.
10. Etude d�un �quilibre ou l��uf sur le plat :
Bibliographie :
Journal of Chemical Education Mars 1997
Exp�rience et mati�re d��uvre :
Dans une bo�te de P�tri, on place des cristaux d�iodure
de potassium de diff�rentes tailles et on ajoute une goutte d�une solution de
nitrate de plomb � 0,1 mol/L sur chaque cristal. On observe des aiguilles
jaunes de PbI2 si le cristal est petit, un c�ur de PbI2
entour� d�aiguilles blanches de KPbI3 (type �uf sur le plat) pour
un cristal de taille moyenne, uniquement KPbI3 pour les plus gros
cristaux ou une solution claire contenant des complexes PbIn(n-2)-.
2 K+ + 2 I- + Pb2+ ![]() PbI2(s) + 2 K+
(1)
PbI2(s) + 2 K+
(1)
PbI2(s) + K+ + I- ![]() KPbI3(s) (2)
KPbI3(s) (2)
La solubilit� de KI est suffisante pour dissoudre de
relativement gros cristaux dans une seule goutte de solution de Pb(NO3)2.
Cependant la pr�sence de forte concentration de KI d�place les �quilibres
vers la droite.
Si le cristal n�est pas assez gros, on observe un m�lange de PbI2
et KPbI3 et avec un petit, seule la premi�re r�action est possible.
Dans le cas o� le m�lange des 2 solides est en �quilibre avec l�iodure de
potassium dissous, il est possible de d�placer l��quilibre, d�apr�s la
loi de Le Chatelier :
Pour tout renseignement suppl�mentaire vous pouvez �crire � : Edith ANTONOT, Professeur de Chimie
m�l :
edith.antonot@ac-nancy-metz.fr
|
|