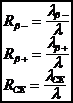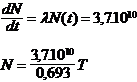Page d'accueil Retour vers les ressources de physique T�l�charger le document
1 Structure de l�atome
1-1 Structure �lectronique et nucl�aire, particules �l�mentaires
L�atome est compos� d�un noyau autour duquel tournent des �lectrons.
Le noyau est compos� de neutron et de proton, qui sont des nucl�ons.
|
Atome ��� 6447448 ���lectron����� �������� noyau ����������������� ����� 64748���������� ���������������������������������� Neutron����� Proton |
����������� proton p+
����������� neutron n�
����������� �lectron e-
masse des particules �l�mentaires
mp ≈ mn ≈ 1830 me�����
mp ≈ mn ≈ 1,67.10-27 kg
me ≈9,1.10-31 kg
La masse des particules �l�mentaires au repos est :
mp = 1,6726432.10-27 kg
mn= 1,6748882.10-27 kg
Charge des particules �l�mentaires
qp = - qe = e = 1,6.10-19 C
1-2 Notation des nucl��des
On note Z le nombre de proton �������� Z est le nombre de charge
On note A le nombre de nucl�on ����� A est le nombre de masse
On note Nle nombre de neutron
����������������������� 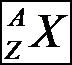 ����� X est le symbole du nucl��de.
����� X est le symbole du nucl��de.
On notera le proton le neutron et l��lectron de la m�me mani�re :
�![]() �����
����� ![]() ���
et
���
et ![]()
Deux atomes ayant :
le m�me Z mais un A diff�rent sont des isotopes
le m�me A mais un Z diff�rent sont des isobares
le m�me N mais un Z diff�rent sont des isotones
Exemple :
isotopes���������� ![]()
isobares���������� ![]()
isotones���������� ![]()
En nucl�aire le symbole ne repr�sente qu�un seul atome et non une mole d�atome.
1-3 Principes fondamentaux
1-3-1 �quivalence masse �nergie
D�apr�s la relation d�Einstein, � toute masse m0, il correspond une �nergie :
E = m0 c2 �� �avec c = 3.108 m.s-1 ������������� (1)
Il en r�sulte qu�une particule au repos poss�de une �nergie, son �nergie de masse au repos.
exemple : calcule de la masse du deut�rium � partir de la masse du proton et du neutron. La masse d�un noyau de deut�rium est� : mD = 3,3445172.10-27 kg
Le noyau de deut�rium est ![]() ,
il est compos� d�un proton et d�un neutron
,
il est compos� d�un proton et d�un neutron
mp+mn= 3,3475314.10-27kg > mD = 3,3445172.10-27 kg
Dm =� -� 0,0030142.10-27 kg
DE = - 2,71278.10-11 J���������� pour un atome
DE = -1,6330935.1013 j �������� pour 2g de deut�rium
1-3-2 Conservation de la charge
Dans toute transformation radioactive ou d�une r�action nucl�aire, le nombre de charge se conserve.
1-3-3 Conservation du nombre de nucl�on
Dans toute transformation nucl�aire, il y a conservation du nombre de masse, donc du nombre de nucl�on.
1-3-4 Conservation de l��nergie
L��nergie existe sous diverses formes :
� �nergie cin�tique ( � mv2 )
� �nergie potentielle� (EK, EL...)
� �nergie rayonnante (hn)
Si on consid�re un syst�me de particules en interaction ce principe s�applique � l�ensemble du syst�me, chaque particules poss�dant une �nergie de masse au repos plus son �nergie cin�tique.
E = m0c2 + Ec = mc2 ������������������������� (2)
m est la masse relativiste avec :
�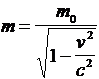 �������������������� ��
�������� �(3)
�������������������� ��
�������� �(3)
����������� �� ����������������� m0 c 2 = m c2- m v2
1-3-5 Conservation de l�impulsion
Une particule en mouvement a une impulsion ou quantit� de mouvement :
![]()
Au cours de l�interaction, l�impulsion totale du syst�me est conserv�e. On en d�duit la relation entre �nergie et impulsion :
E2 = p2c2 + (m0c2)2 ��������������������������� (4)
d�monstration de la formule (4):
(2)� � E = m0c2 + Ec = mc2 ��
(3)� � 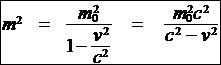
������ c2 * �������� �� m02c2 = m2c2 - m2v2
����������������������� ��� m2c4 = m02c4 + p2c2
����������������������� ������ E2 =� m02c4 + p2c2
1-3-6 Dualit� onde-corpuscule
En 1905 Einstein montre que l�aspect ondulatoire de la lumi�re n�est pas la seule manifestation d�une onde �lectromagn�tique. Il �met l�hypoth�se qu�� toute onde �lectromagn�tique de fr�quence n, peut �tre associ�e une corpuscule : le photon dont l��nergie quantifi�e est
En = hn = hc/l
o� h est la constante de planck�� h = 6,62.10-34 J.s et c = 3.108 m/s
Pour le photon la masse est nulle, car il se d�place � la vitesse limite de la lumi�re, donc :
m0c2 = 0
E = pc
p = E/c = hn/c
�Il en r�sulte que les quanta de lumi�re ont une impulsion p dans la direction de la lumi�re.
Par analogie Louis de BROGLIE en 1924 �met l�hypoth�se r�ciproque qu�� toute particule d�impulsion p est associ�e une onde de longueur d�onde
l = c/n = h/p = h/mv
1-4 Grandeurs li�es � l�atome
1-4-1 Longueur
le diam�tre d�un atome est de l�ordre de grandeur de l�angstr�me (�)� ( 10-10 m)
Le Rayon de Bohr de l�atome d�hydrog�ne est rH = 0,59 �
Le rayon du proton est de l�ordre du femtom�tre ( 10-15 m)
Le rayon d�un noyau� lourd est de environ 7 fm
Le rayon du noyau de l�atome varie en fonction du nombre de nucl�on A :
R = R0. A 1/3 � avec R0 = 1,2 fm
1-4-2 Le temps
L��chelles de temps des ph�nom�nes nucl�aires est tr�s �tendu. Elle varie de 10-20s r�action nucl�aire � 109 ans (d�sint�gration nucl�aire )
Dans la pratique on utilise l�unit� la mieux adapt�e au ph�nom�ne.
1-4-3 �nergie
L�unit� d��nergie en nucl�aire est l��lectron-volt� (eV).
1 eV = 1,6.10-19 J������� 1 J = 0,625.10+19 eV = 0,625.10+13 MeV
1-4-4 Masse
L�unit� l�gale de masse est le kg. Beaucoup trop grand pour les atomes :
(mp ≈ mn ≈ 1,67.10-27 kg)
On va donc utiliser des unit�s mieux adapt�es :
� L�unit� de masse atomique ( u )
1 u est le 1/12 de la masse d�un atome de carbone 12 ( 12C)
or une mole de carbone 12 a une masse de 12 g
donc� :
![]()
� MeV.c-2
� chaque masse m0 peut �tre associ�e une �nergie : l��nergie de masse
E = m0.c2 ������� avec ��� c= 3.108 m/s E en joules m en kg
si E en MeV
1 MeV = 1,6.10-13 J��� 1 J = 0,625.1013 �MeV
Pour d�terminer la masse en MeV.c-2 on calcule l��nergie de la masse m0 en MeV :
exemple : masse du proton au repos� mp = 1,67.10-27.kg
����������� E = 1,67.10-27.9.1016 J
����������� ![]()
����������� E = mp .c2
����������� mp = 939,375�� MeV.c--2
Valeurs des masses� des particules �l�mentaires
|
masse en |
u |
MeV.c--2 |
|
e- |
5,485.10-4 |
0,511 |
|
p+ |
1,00727 |
938,28 |
|
n0 |
1,00866 |
939,57 |
|
u |
1 |
931,5 |
|
a |
4,00150 |
3727,41 |
2 Mod�le atomique
2-1 Structure �lectronique postulat de Bohr���
� Un �lectron, dans un atome, d�crit une orbite autour du noyau �sous l�influence de l�attraction Coulombienne entre �lectron et noyau .
� Le moment angulaire orbital de l��lectron L = mnr ne peut varier que de mani�re discr�te. Il est quantifi� seules sont permises les orbites pour lesquelles :
2pL = nh ������������������ avec n = 1,2,3,...
� Sur une orbite permise l��lectron, bien que constamment acc�l�r� ne rayonne pas d��nergie. Son �nergie totale est constante.
� Un rayonnement �lectromagn�tique n�est �mis que si un �lectron saute d�une orbite d��nergie Ei sur une autre orbite permise d��nergie inf�rieure Ef .
L��nergie rayonn�e est
E = Ef - E i < 0 ���������� �(E<0 car �nergie c�d�e)
Chaque orbite correspond � un �tat d��nergie de l�atome.
2-2 Niveaux d��nergie
����������� L��nergie totale de l��lectron sur un niveau d��nergie est la somme de son �nergie potentielle et de son �nergie cin�tique Ec. l��nergie potentielle est nulle si l��lectron est � l�infini.
En = Ep + Ec��������������� ![]()
�����������
or�� ![]() ���������� � ������
���������� � ������ ![]() ������� donc �� �
������� donc �� �![]()
Le moment cin�tique �2pL = nh ������ avec
��� ![]()
L = nh = mvr
On montre que pour l�atome d�hydrog�ne Z = 1
![]()
|
|
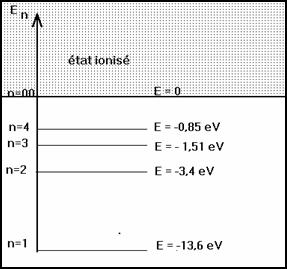
Pour n > 1 les �tats sont excit�s et instables ; la dur�e de vie dans un �tat excit� est de l�ordre de la nanoseconde ( 10-9 s).
�
Pour n = 1 l�atome est dans l��tat fondamental.
Pour n = ∞ l�atome est ionis�.
2-3 Nombres quantiques, structure hyperfine
����������� n nombre quantique principal ���������� n = 1, 2, 3 ,...
� l nombre quantique azimutal ������� l = 0 ,1 ,2 ,3 ,....
� ml nombre quantique magn�tique ml = -l ,-l+1 ,....,0 ,1 ,2 ,...., l-1 ,l
� s spin ������������������������������������������� s = � �
n �������� correspond au niveau d��nergie
ml ������ correspond au moment cin�tique ( sens de rotation de l��lectron autour du noyau. ��������� C�est � une charge �lectrique qui tourne donc cr�e un champ magn�tique)
s��������� le spin correspond � la rotation de l��lectron sur lui-m�me.
2-4 Principe d�exclusion de Pauli
Si un atome a un num�ro atomique Z la charge autour du noyau est Ze
Les Z �lectrons ne peuvent pas avoir le m�me �tat quantique.
Il faut donc que les 4 nombres quantiques ne soient pas identiques pour 2 �lectrons quelconques.
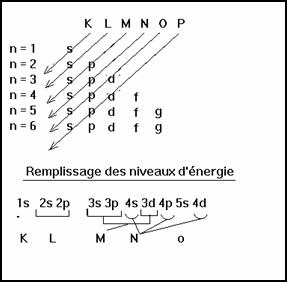
2-5 Configuration �lectronique d�un atome
Pour un m�me niveau d��nergie le nombre quantique n est le m�me.
|
niveau |
n |
l |
m |
s |
�tats |
|
K |
n = 1 |
l = 0 |
m = 0 |
s =� � � |
1s2 |
|
L |
n = 2 |
l = 0 l = 1 |
m = 0 m = 0, � 1 |
s =� � � s =� � � |
2s2 2p6 |
|
M |
n = 3 |
l = 0 l = 1 l = 2 |
m = 0 m = 0, � 1 m = 0, � 1, � 2 |
s =� � � s =� � � s =� � � |
3s2 3p6 3d10 |
|
N |
n = 4 |
l = 0 l = 1 l = 2 l = 3 |
m = 0 m = 0, � 1 m = 0, � 1, � 2, � 3 m = 0, � 1, � 2, � 3, � 4 |
s =� � � s =� � � s =� � � s =� � � |
4s2 4p6 4d10 4f14 |
L��nergie de liaison d�un �lectron varie de quelques �lectrons-volts � quelques centaines de keV pour les atomes les plus lourds et les �lectrons les plus li�s ( les plus profonds).
A l��tat fondamental les �lectrons d�un atome sont au niveau le plus bas possible.
Ordre de remplissage des niveaux d��nergie par les �lectrons
|
|
Le remplissage du sous niveau 3d correspond � la s�rie des Lanthanides et celui des 4d � la s�rie des actinides.
Les Lanthanides sont tous dans la case 57 du tableau de Mendele�ev et les actinides sont tous dans la case 89 de l�actinium.
Il est � noter qu�il� y a quelques irr�gularit� dans le remplissage au niveau du nickel et cuivre, du Techn�tium et Ruth�nium, ainsi que de l�iridium et platine.
2-6 Le noyau
2-6-1 �tats d��nergie du noyau.
Le noyau ![]() �contient
Z protons et N = A - Z� neutrons.
�contient
Z protons et N = A - Z� neutrons.
L��nergie du noyau au repos est :
M(A,Z) c2� = Z Mp c2 + N Mn c2� -� B
�avec��� Mp c2 = 938,28 MeV�������������� �nergie de masse du proton
����������� Mn c2 = 939,59 MeV�������������� �nergie de masse du neutron
B �nergie de liaison totale des A nucl�ons, ou d�faut de masse ( B � Binding : liaison en anglais).
On appelle� ![]() �l��nergie
moyenne de liaison par nucl�on.
�l��nergie
moyenne de liaison par nucl�on.
On peut constater que cette �nergie de liaison par
nucl�on est maximum de A = 60 � A = 90. Cela correspond aux noyaux les plus
stables ![]() �≈
9 MeV.
�≈
9 MeV.
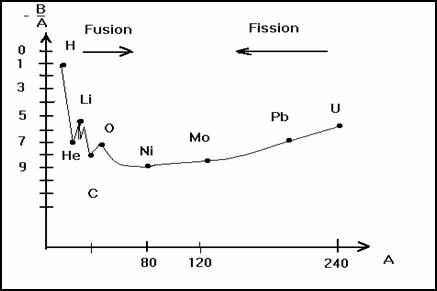
Si A < 30� ![]() �varie
peu et est voisine de 8 MeV. C�est une valeur forte compar�e � l��nergie de
liaison des �lectrons. On peut obtenir de 2 fa�ons des noyaux de grande �nergie
de liaison par nucl�on.
�varie
peu et est voisine de 8 MeV. C�est une valeur forte compar�e � l��nergie de
liaison des �lectrons. On peut obtenir de 2 fa�ons des noyaux de grande �nergie
de liaison par nucl�on.
� Soit en cassant un noyau lourd en deux noyaux plus l�gers : c�est la fission.
� Soit en assemblant deux noyaux l�gers en un noyau plus lourd : c�est la fusion
2-6-2 Forces nucl�aires
La coh�sion du noyau est due � l�interaction nucl�aire forte.
Caract�ristiques des forces nucl�aires :
� Attractives et tr�s intenses (forte �nergie de liaison des nucl�ons)
� De tr�s courte port�e ≈ 1 fm (diff�rente de la coulombienne � longue port�e en 1/r2 )
� Ind�pendante� de la charge ( les forces d�attraction n-n, p-p et n-p identiques)
� Elles sont satur�es. Le vecteur interaction est le m�son p
2-6-3 �tats excit�s : processus de d�sexcitation�
2-6-3.1 D�sexcitation de l�atome
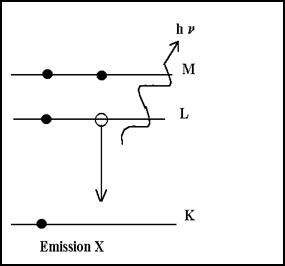
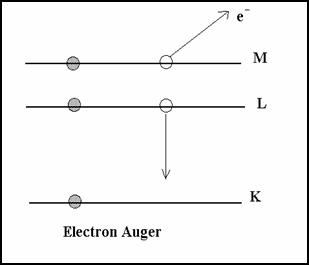
Si le cort�ge d��lectron est modifi� par une collision avec un projectile, l�atome se trouve excit� dans un �tat instable de courte dur�e (10-8 � 10-15 s). Si un proton p+ arrache un �lectron e- de la couche K, l�atome est ionis�. il y a une vacance �lectronique.
Il y a d�sexcitation par un �lectron de niveau� sup�rieur (en g�n�ral L) puis M comble L puis N comble M ...
����������� La transition L� K lib�re une �nergie E = EK- EL� < 0
La d�sexcitation peut s�effectuer par deux processus :
� soit une �mission X
� soit par effet AUGER
* Emission X
L��nergie est emport�e par un photon d��nergie hn
hn = | (EL-EK)| ���������� �nergie ≈ 120 keV
Il y a un grand nombre d��mission possible, car il y a plusieurs niveaux d��nergie et sous niveaux d��nergie. L�onde �lectromagn�tique est en mode transverse.
* Effet Auger
Ce processus est non radiatif, l ��nergie disponible est directement transf�r�e sans �mission X � un �lectron du cort�ge qui est �ject� de l�atome avec une �nergie cin�tique �gale � l��nergie lib�r�e diminu�e de l��nergie de liaison de l��lectron.
C�est un processus d�auto-ionisation de l�atome. L�effet Auger est pr�dominant pour les �l�ments l�gers. L��mission X pr�domine pour les �l�ments lourds.
Dans l�effet Auger le champ� �lectrique est en mode radial.
Il y a comp�tition entre �mission X et l�effet Auger.
|
|
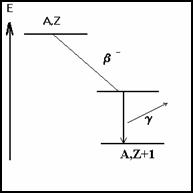
2-6-3.2 D�sexcitation du noyau
����������� Tr�s souvent apr�s �mission a �ou �b ou apr�s une r�action nucl�aire (capture, fission, fusion) le noyau est dans un �tat excit�.
Les �tats d��nergie du noyau sont quantifi�s comme ceux de l�atome.
Il existe deux processus de d�sexcitation du noyau :
� par �mission g
� par conversion interne
� �mission g
����������������������� Ce sont des rayonnements �lectromagn�tiques de m�me nature que les rayons X mais plus �nerg�tiques, donc de plus grande fr�quence.
����������� On montre que l��nergie de recul du noyau est de l�ordre de :
ER = 50 eV
et que l��nergie du photon g� est de l�ordre de :
Eg ≈ 2 MeV
donc ER << Eg ≈ Ei -Ef�
L��nergie Eg �est de l'ordre de 10 keV � 3 MeV.
� Conversion interne
La conversion interne est un processus non radiatif de d�sexcitation du noyau. L��nergie est c�d�e directement � un �lectron du cort�ge �lectronique ( le plus souvent du niveau K) qui est �ject� avec une �nergie :
Ee- = E - B������ B �nergie de liaison��� E �nergie de d�sexcitation
A la suite de la conversion interne le cort�ge �lectronique se r�arrange avec �mission de rayon X ou d��lectron Auger.
3 La Radioactivit�
3-1 D�finition ������
����������� Certains nucl�ides se transforment� spontan�ment au cours du temps. Cette transformation correspond � un changement de nature du noyau. Cette transformation se fait par �mission de particule a ou b ou par fission spontan�e ou par capture �lectronique. Cela se passe pour les noyaux lourds ou qui ont un exc�s de neutron ou de proton.
����������� Ces noyaux sont dits � Radioactifs � ils se d�sint�grent. Ce ph�nom�ne est ind�pendant des conditions physico-chimiques du nucl�ide et de l��ge du nucl�ide.
����������� La probabilit� que, pendant un temps dt, le nucl�ide consid�r� se d�sint�gre est une donn�e caract�ristique de ce nucl�ide.
3-1-1 Loi de d�sint�gration radioactive
����������� Soit un nombre N(t) d�atomes radioactifs d�une esp�ce pr�sents � la date t.
����������� Entre t et t + dt un certain nombre de noyaux se sont d�sint�gr�s et ont chang� de nature.
����������� On appelle dN la variation du nombre d�atome entre ces deux dates. Cette variation est proportionnelle au nombre N(t) d�atomes � la date t, d�pend du nucl��de consid�r� et de la dur�e dt.
dN = - N l dt�� (- car il y a diminution de N)
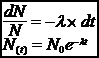
����������� l est la constante radioactive du nucl��de
����������� N0 est le nombre d�atomes pr�sents � la date t = 0
����������� La d�croissance radioactive suit une loi exponentielle.
3-1-2 P�riode radioactive
����������� La p�riode T est le temps n�cessaire pour que la moiti� des N0 atomes pr�sents � la date t=0 se soient d�sint�gr�s.
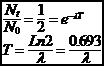
Les p�riodes T des diff�rents radio�l�ments couvrent un domaine tr�s vaste, depuis
T > 1030 ans pour le vanadium ��������� �
T < 2.96.10-7
s pour ![]()
3-1-3 Vie moyenne
����������� La vie moyenne d�un atome particulier est comprise entre 0 et ∞ . Si on a N0 atomes pr�sents � t = 0 � t il en reste :
N(t) = N0 e -lt�
entre t et t + dt , dNt atomes se d�sint�grent
dN(t) =� - l N(t) dt
ces dN(t) atomes ont eu une vie �gale � t
La dur�e de vie totale de l�ensemble est
dN(t) .t =� - l N(t) t� dt
Par d�finition la vie moyenne t des N0 atomes est la somme des dur�es de vie de tous les atomes divis�e par N0 .
![]()
or ������������������ N(t) = N0 e -lt�
![]()
on int�gre par partie, on obtient t = l-1�
or������������������� N(t) = N0 e -lt ������� �si ���� t = t = l-1
donc �������������� N(t) = N0 e -l/l = N0 e-1
![]()
La vie moyenne correspond au temps au bout duquel le nombre d�atomes a d�cru d�un facteur 1/e.
3-2 Mode de transformation spontan�e
����������� On peut classer en deux cat�gories les modes de transformation :
� Transformation isobarique ( A = cte)
� Transformation par partition en 2 noyaux.
3-2-1 Transformation isobarique
����������� Ce sont des transformations sans changement du nombre de masse A. Ceci est du � un d�s�quilibre trop important entre les neutrons et protons dans le noyau.
3-2-1.1 �mission b + �
����������� La particule b+� est un positon, car il y a trop de protons dans le noyau.
![]()
On peut consid�rer que c�est un proton qui se transforme en un neutron
![]()
n est un neutrino de charge nulle et de masse vraisemblablement nulle.
exemple :
![]()
3-2-1.2 �mission b - �
����������� La particule b- est un �lectron expuls� du noyau. Il y a �mission d'un antineutrino, pour conservation de l'�nergie. On peut consid�rer que b- �correspond � la transformation d�un neutron en proton, car il y a un exc�s de neutron dans le noyau.
![]()
exemple :
![]()
3-2-1.3 Diagramme d��nergie
����������� Les particules b ont une �nergie qui n�est pas quantifi�e. Mais le nombre de positon ou �lectron est maximum pour une �nergie de 0,58 MeV
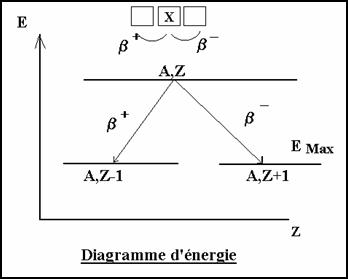
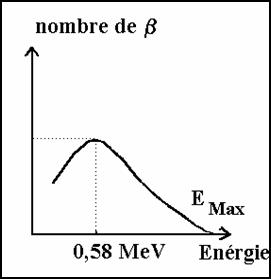
����������� figure 1��������������������������������������������������������� ����� figure 2
L��nergie des particules b �mis n�est pas constante pour un type de d�sint�gration.
EB � EA,Z - Ea,Z�
Sur un nombre tr�s grand de d�sint�grations b on observe une r�partition d��nergie des particules de la forme de� la� figure 2. Le maximum de particule a une �nergie (EMax) *1/3
����������� On peut d�terminer Emax :
Emax + m0c2 = M�(A,Z) c2 - M(A,Z � 1) c2
o� m0 est la masse au repos, de la particule b .On constate que toutes les particules
b� n�ont pas la m�me �nergie cin�tique. On obtient un spectre continu d��nergie (figure 2).
����������� Par exemple pour le phosphore 32 qui est un �metteur b-
![]()
�l��nergie est :
EP = 15 Mp c2 + 17 Mn c2 - B������������ ( B �nergie de liaison : binding)��������
Pour le soufre 32
ES = 16 Mp c2 + 16 Mn c2 - B
L��nergie disponible est E = D E =1.732 MeV
Donc sauf dans le cas rare o� l��nergie des b �est Emax , il n�y a pas conservation de l��nergie; donc on est oblig� de supposer l�existence d�une particule sans masse et sans charge : le neutrino.����������� Son �nergie de masse est :
|
|
mn c2 < 10 eV
Le neutrino est une particule tr�s p�n�trante, mais non ionisante, qui n�interagit pas avec la mati�re.
Mais dans de nombreux cas le noyau final est dans un �tat excit�. Il y a lib�ration d�un photon g
On peut �crire :
�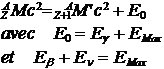
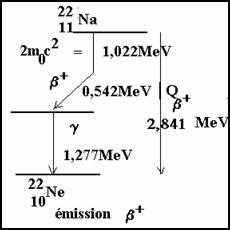
Pour les b+ : si on appelle M� la masse du noyau, et M la masse de l�atome on peut �crire :
![]()
si on ajoute aux deux membres la masse de Z �lectrons on obtient :
![]()
Si on appelle Qb+ la diff�rence des masses atomiques des atomes lors de la d�sint�gration b+
![]()
Pour que la d�sint�gration b+ soit �nerg�tiquement possible, il faut que :
Qb+ ≥ 2m0c2 = 2*0,511 MeV = 1,022 MeV
Pour b- il faut que �![]()
Si on ajoute les Z �lectrons c�est � dire une masse� Zm0c2 aux deux membres avec m0 masse de l��lectron au repos on obtient :
![]() �
�
![]()
3-2-1.4 Capture �lectronique
����������� Il peut y avoir au lieu d�une �mission d�une particule b+ , une capture �lectronique avec transformation d�un proton en neutron :
p+ + e- � n + n�
I l y a transformation dans le noyau d�un proton en neutron comme dans l��mission b+ La capture �lectronique est en concurrence avec l��mission b+ . Le noyau r�siduel est laiss� dans un �tat excit�, et il y aura �mission d�un photon g .
![]()
L��nergie de d�sint�gration est
E0= EM� +En + Eg � EM� +Eg �
Si on ajoute (Z-1) m0 c2� aux deux membres on obtient :
![]()
E0 = QCE
La capture �lectronique ne peut se produire que si QCE > 0 c�est � dire si
|
ZM > Z-1 M |
L��mission b+ n�est possible que si ��� ZM > Z-1M + 2m0
Par exemple :
 ������������������������ �
������������������������ �
����������� Si�� Q > 2 m0 c2 ���������� la capture �lectronique est pr�pond�rante devant b+ pour les atomes lourds (Z grand) car les �lectrons sont en moyenne plus pr�s du noyau.
����������� Apr�s une capture �lectronique, il y a r�arrangement du cort�ge �lectronique soit par �mission X caract�ristique de l�atome fils, soit par �mission d��lectron Auger.
3-3 D�sint�gration a
����������� C�est une d�sint�gration non isobarique, avec �mission d�un noyau d�H�lium He
![]()
Ma = 4,00150 u
Ma c2 = 3727,41 MeV
Energie de liaison totale B = 28,3 MeV
Energie de liaison par nucl�on B/A = 7,07 MeV/nucl�on
|
noyau |
2H |
3H |
3He |
4He |
6Li |
7Li |
|
B (MeV) |
2,22 |
8,48 |
7,72 |
28,3 |
32 |
9,2 |
|
B/A |
1,11 |
2,83 |
2,57 |
7,07 |
5,33 |
5,60 |
����������� On peut remarquer que l��nergie de liaison par nucl�on est la plus grande pour la particule a donc c�est une particule tr�s stable.
3-3-1 Energie de la d�sint�gration a�
Il y a conservation de l��nergie lors de la r�action :
![]()
Ea �et EM� sont les �nergies de recul de la particule� a et du noyau fils. Si on �crit la conservation de la quantit� de mouvement
M�Vr = M�a Va �������� �� Vr = Va *(M�a/M�)
L��nergie de recul du noyau est :
![]() ����� or �������
����� or ������� ![]()
![]()
Les �metteurs
a sont des noyaux lourds A @ 200 donc���� ![]()
EM�@0,02 Ea�� et si Ea = 5 MeV���� EM�@ 100 keV
L��nergie totale ou �nergie de d�sint�gration sera :
![]()
![]()
![]()
La d�sint�gration a ne peut donc avoir lieu que si����� Qa > 0��������� � ������ A > 140
L��nergie de d�sint�gration� a varie dans une bande �troite de 4 � 9 MeV. On constate que l��mission a donne plusieurs raies voisines ; on observe une structure fine.
3-3-2 P�riode des �metteurs a
La p�riode des �metteurs a varie de 10-7 s � 1010 ans.
Plus l��nergie est grande plus la p�riode est courte.
|
Nucl�ide |
Ea ( MeV) |
P�riode T |
|
232 Th |
4.05 |
1,39.1010 ans |
|
226 Ra |
4.88 |
1,62.103 ans |
|
228 Th |
5.52 |
1,9 ans |
|
222Rn |
5.59 |
3,83 jours |
|
218 Po |
6.12 |
3,05 min |
|
216 Po |
6.89 |
0,16 s |
|
212 Po |
8.95 |
3.10-7 s |
3-3-3 Noyaux ayant plusieurs modes de d�sint�gration
Certains noyaux ont plusieurs modes possibles de d�sint�gration.
Par exemple :
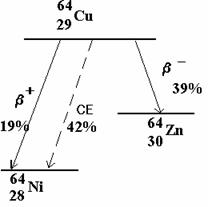
����������� Le 64Cu se d�sint�gre soit par �mission b- ou b+ soit par capture �lectronique CE.
����������� Chaque mode de d�sint�gration est caract�ris�e par sa probabilit� partielle par unit� de temps :
lb- ������� �lb+ ������ �lCE
Chacune de ces probabilit�s est ind�pendante. La constante l de d�sint�gration du cuivre 64Cu est :
l = lb- ��+ lb+ ����������������� + lCE