STAGE "RELATION ACTIVITÉ PHYSIQUE - PARAMÈTRES PHYSIOLOGIQUES"
Lycée J.Callot 54500 VANDOEUVRE - FÉVRIER 2001
Pr. Anne-Marie Bautz
Laboratoire de Biologie expérimentale-Immunologie
EA 2401 Génétique et Interactions Cellulaires en Reproduction
UHP NANCY 1 Faculté des Sciences B.P. 239
54506 VANDOEUVRE les NANCY CEDEX
Jean-Yves Boulanger
Professeur de SVT - Lycée J.Callot 54500 VANDOEUVRE les NANCY
Objectifs : - observation des contractions
cardiaques d'un cœur embryonnaire de Vertébré ;
- mise en évidence de l'automatisme cardiaque ;
- plan d'organisation d'un Vertébré.
Matériel : - œufs embryonnés de caille ;
- matériel de dissection (pinces moyennes, pinces courbes bouts fins, ciseaux
fins ;
- pour la dissection du cœur : pinces brucelles et ciseaux de Dowell ;
- verres de montre, lames (éventuellement à concavité), boîtes de Petri, récipients
de type "ramequin" ;
- pipettes Pasteur en polyéthylène (pour ajout de fixateur) ;
- liquide de Tyrode simple à température voisine de 38 °C ;
- fixateur de Clarke (pour une éventuelle conservation) ;
- gants et chiffons ;
- loupe binoculaire, lampe additionnelle.
Plan :
4.1. Rappels embryologiques du développement de l'œuf d'Oiseau (données concernant la Poule)
4.1.1 Structure d'un œuf télolécithe de Poule
4.1.2. Premières divisions de l'œuf de Poule
4.1.3. Aspect du blastoderme au moment de la ponte
4.1.4. Formation de la ligne primitive
4.1.5. Formation du prolongement céphalique
4.1.6. Stade 20 heures : apparition de la première paire de somites
4.1.7. Différenciation du système nerveux et du cœur
4.2. Mise à l'étuve des œufs de caille
4.3. Ouverture de l'œuf
4.4. Isolement du cœur et automatisme cardiaque
4.5. Compositions des liquides utilisés
Remarques :
-
les macrophotographies ont été réalisées par un camescope numérique qui présente l'avantage d'une visée réflexe (donc un bon cadrage), une mise au point dès 0 mm et le transfert direct des images obtenues sur un ordinateur.
-
dessins copyright A-M.Bautz.
4.1. Rappels embryologiques du développement
de l'œuf d'Oiseau (données concernant la Poule)
Les documents proposés ont été réalisés par A-M. Bautz et publiés dans le "Manuel pratique d'embryologie expérimentale" (J.Schilt, A-M.Bautz, A.Bautz) édité chez Masson en 1981.
Le développement de l'œuf de Caille est de 17 jours, par comparaison avec les 21 jours de la Poule. Mais la conséquence n'est pas sensible sur la période de 48h à 72h d'incubation qui nous concerne ici. De même, les tailles des embryons de Caille et de Poule ne sont pas très différentes à ces stades.4.1.1 Structure d'un œuf télolécithe de Poule
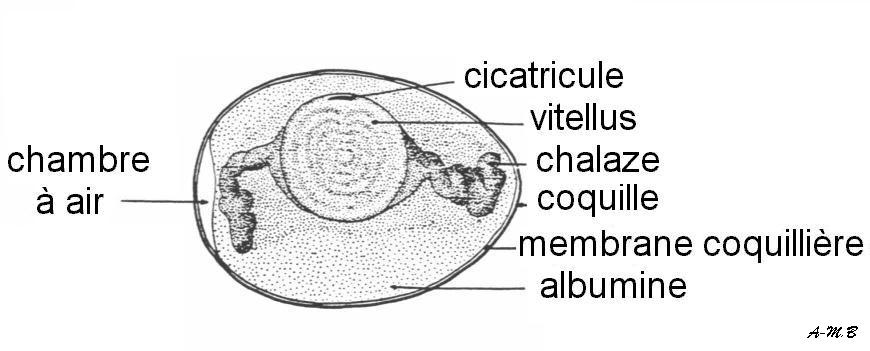
La respiration se fait par toute la surface de la coquille, d'où l'importance d'éviter un support imperméable aux gaz.4.1.2. Premières divisions de l'œuf de Poule
Elles se produisent dans l'oviducte, avant la ponte.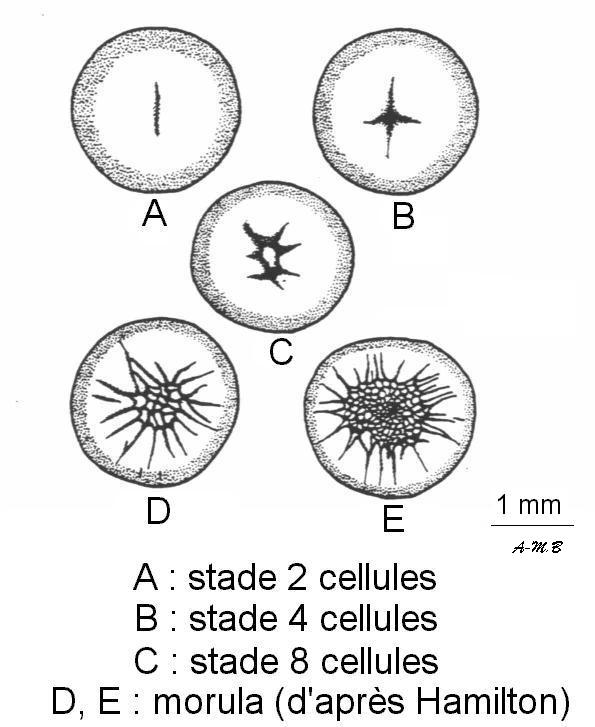
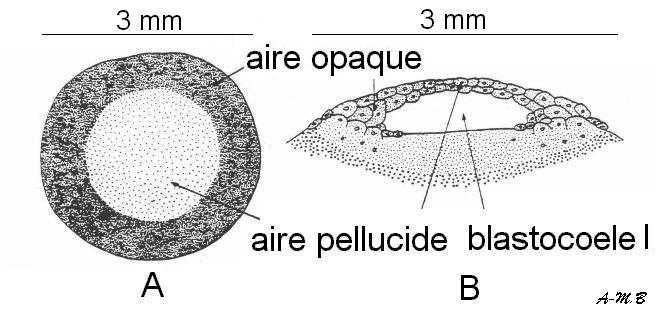
A : blastoderme monté in toto B : Coupe dans un blastoderme au même stade (d'après Houillon)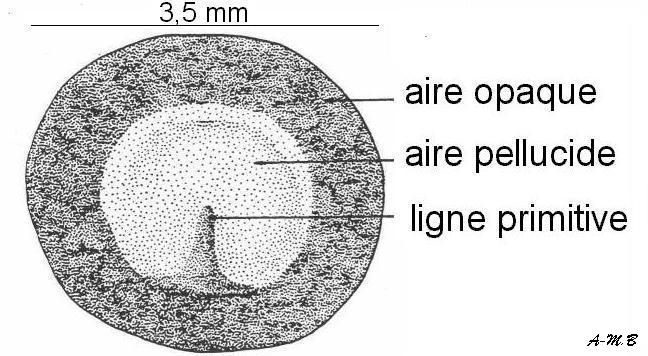
Ligne primitive jeune = amas de cellules dans la région basale de l'aire pellucide
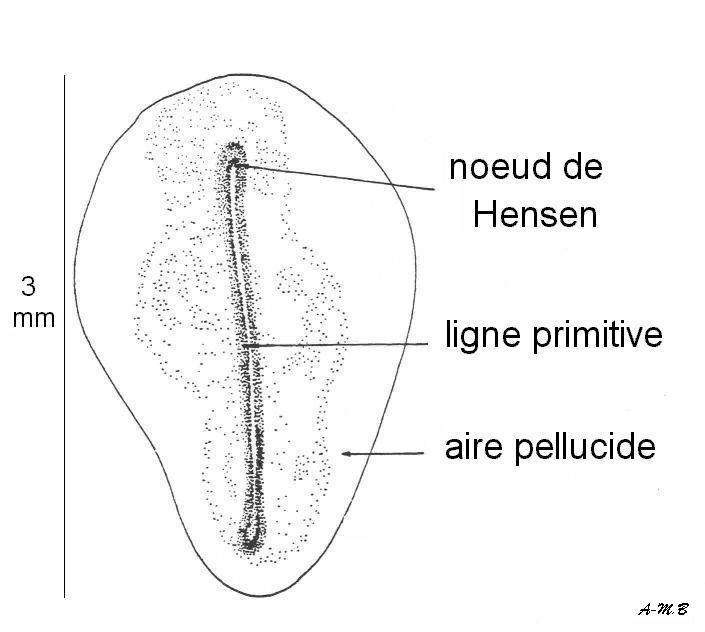
Ligne primitive complète = l'endoderme puis le mésoderme s'invaginent le long du sillon
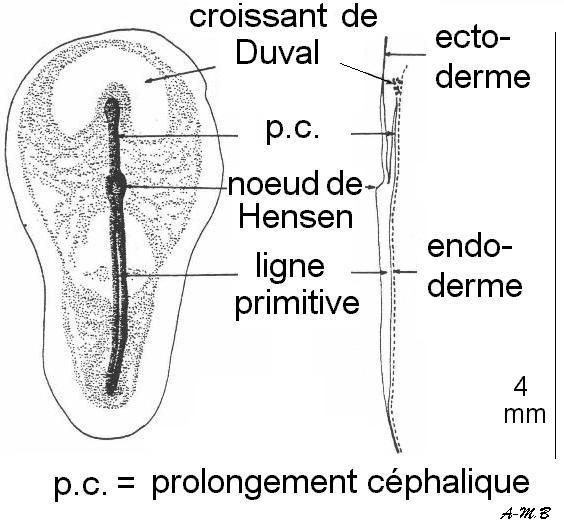
A : montage in toto B : coupe longitudinale
Le mésoderme invaginé vers l'avant forme un cordon plein : c'est le prolongement céphalique qui donnera la corde.
Ce dernier en grandissant repousse vers l'avant l'endoderme I qui forme alors le croissant de Duval.
4.1.6. Apparition de la première paire de somites (stade 20 heures)

Découpage du mésoderme paraxial en blocs formant les somites. La plaque neurale se forme. Il apparaît ensuite une paire de somites par heure, ce qui permet d'évaluer l'âge de l'embryon.
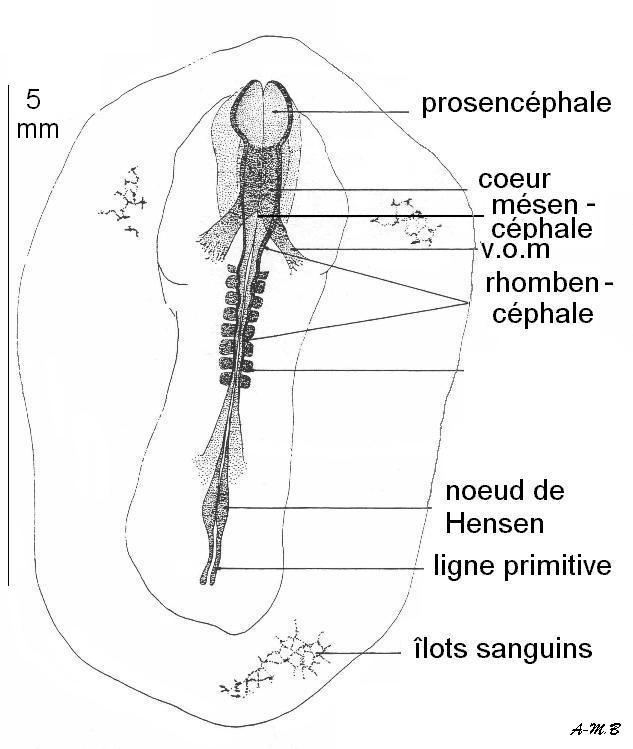
4.1.7. Différenciation du système nerveux et du cœur
Stade 7 somites : le cerveau se divise en trois vésicules ; le cœur, tubulaire, reçoit le sang des veines omphalomésentériques.
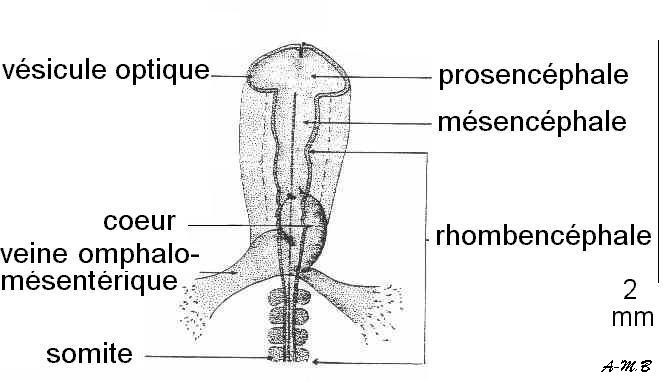
Stade 11 somites : le cœur se courbe sur lui-même (il prend la forme d'un S).
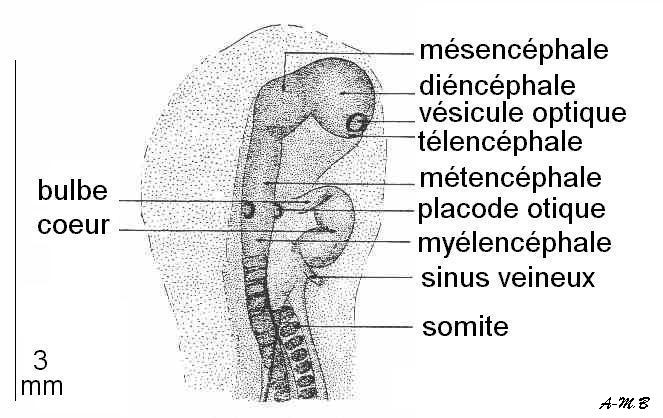
Stade 16 somites : la torsion du cœur est bien visible. C'est vers ce stade que peut être isolé le cœur afin de montrer l'automatisme cardiaque.Remarque : le plus souvent, l'embryon se couche sur le côté gauche.
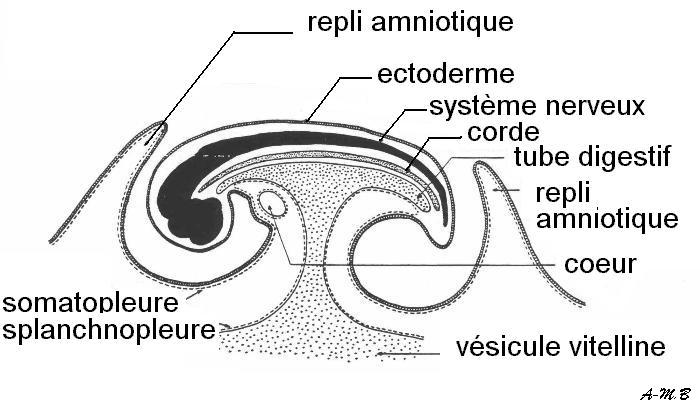
Coupe sagittale schématique de l'embryon.
4.2. Mise à l'étuve des œufs de cailleUne étuve du type « Jeulin » peut accueillir 80 œufs de caille répartis et calés horizontalement (sinon il n'y a pas développement) dans les perforations des clayettes en aluminium, tout en assurant une bonne circulation d'air. Ce type d'étuve, facile à transporter, peut être placée au domicile de la personne responsable de la mise en place des œufs lors d'un week-end en fonction du moment du T.P. ...

(photo 1)
Conditions à respecter :
- percer doucement les extrémités de l'œuf (photo2) ;
- tenir l'œuf verticalement, gros bout vers le bas, et l'agiter doucement par deux ou trois petits à-coups afin de décoller les membranes coquillières et de permettre à la chambre à air de venir se placer au-dessus de l'embryon lorsqu'on replace l'œuf à l'horizontale (photo3) : l'ouverture d'une fenêtre dans la coquille est alors possible sans léser l'embryon ;
4.3. Ouverture de l'œuf (dissections du Pr. Bautz
ou de stagiaires)
Deux possibilités s'offrent :
1. Observation in situ
 . .
. .
(photo2) (photo3)
- pour réaliser cette ouverture, utiliser des pinces moyennes (photo 4) en veillant à ne pas trop les enfoncer pour ne pas léser l'embryon situé en-dessous ;

(photo 4)
- les contractions cardiaques sont visibles à l'oeil nu mais l'observation sera bien meilleure avec une loupe binoculaire : le sens unique de circulation intracardiaque sera alors nettement visible.
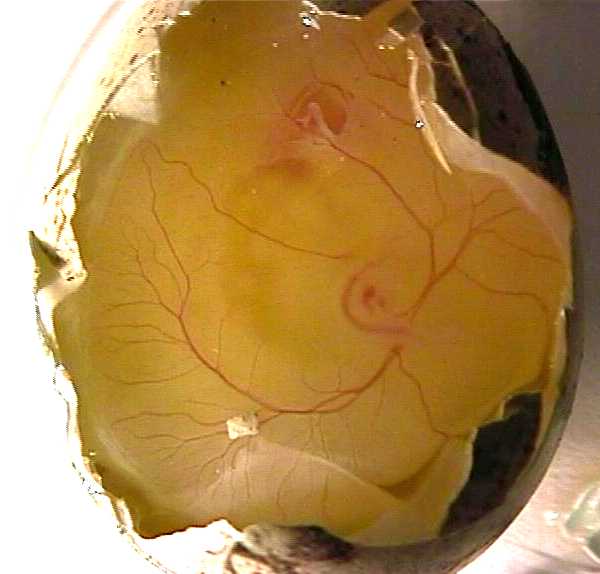
(photo 5)
- immerger l'œuf dans un récipient empli de Tyrode, ouvrir l'œuf en découpant la coquille selon un plan sub-équatorial décalé du côté du gros bout (photos 6 et 7) ;
2. Observation en dehors de la coquille
Cette technique permet d'isoler l'embryon du jaune.
 . .
. .
(photo 6) (photo7)
- la zone embryonnaire est visible à la surface supérieure du jaune (photo8) ; si l'embryon est en-dessous du jaune, retourner ce dernier en utilisant les chalazes ;
(photo8)
- il est possible d'observer les battements cardiaques (deux phases illustrées par les photos 9 et 10)
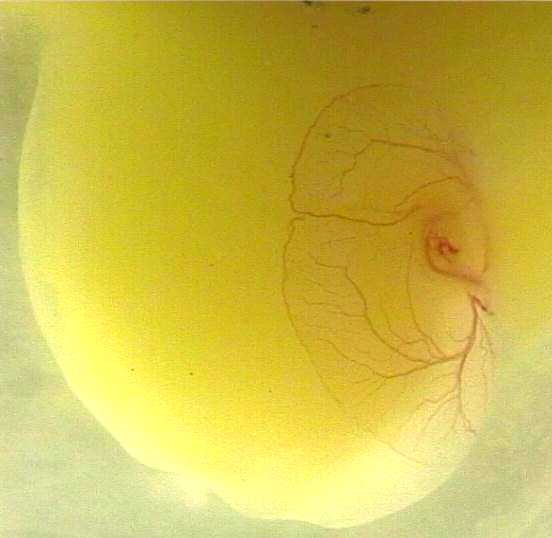 . .
. .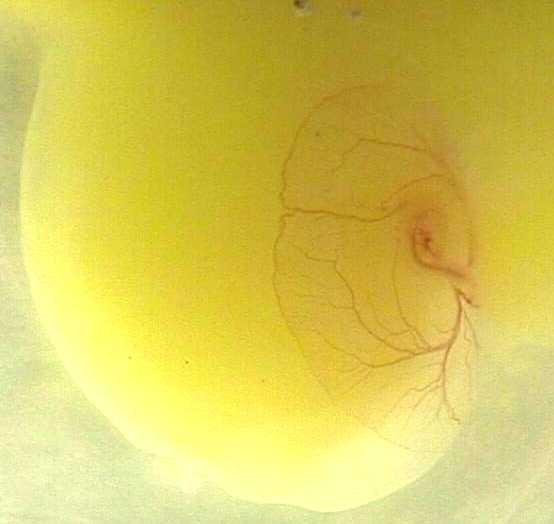 .
.
(photo9) (photo10)
- toujours dans le Tyrode, découper cette zone embryonnaire avec des ciseaux fins en maintenant le jaune à l'aide des pinces courbes (côté courbe vers le jaune : photo 11)

(photo 11)
- à l'aide d'une pince courbe, détacher la zone embryonnaire par de légers mouvements puis la transférer dans un verre de montre contenant du Tyrode (photo 12) ;
- faire ensuite glisser la partie découpée dans une boîte de Petri contenant du Tyrode propre (photo 13) ;
- si nécessaire, enlever la membrane vitelline (transparente mais gélatineuse) qui recouvre l'embryon : ceci se fait en agitant doucement la zone découpée à l'aide des pinces.
 . .
. .
(photo 12) (photo13)
- une observation au vidéomicroscope est réalisable si le transfert est réalisé sur une lame (montage au Tyrode, sans lamelle) :
Vidéo de cœur d'embryon en détail avec circulation des hématies (fichier .avi de 1182 ko)
- l'ensemble peut être fixé par un conservateur :
- à l'aide d'une pipette, aspirer tout le Tyrode et le remplacer par du fixateur de Clarke ajouté autour de la zone embryonnaire et non directement dessus (photo14) ;
- donner à la boîte un léger mouvement de bascule pour éviter que l'embryon ne reste collé au fond : l'embryon doit flotter dans le fixateur (photo15);
- après une heure de fixation, le fixateur sera remplacé par de l'éthanol à 90° ;
- pour une bonne conservation, le placer dans l'éthanol à 70° qui s'évapore moins vite et durcit moins les tissus.
 . .
. .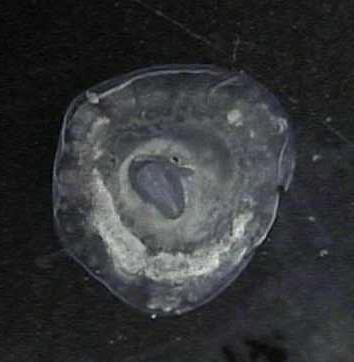
(photo 14) (photo 15)
- l'embryon peut aussi être coloré et monté entre lame et lamelle :
- l'embryon devenu blanc ( 5 à 10 min après fixation), éliminer le fixateur à la pipette et rincer deux fois à l'éthanol à 95° en agitant légèrement la boîte :
- après élimination de l'éthanol, immerger l'embryon dans le colorant (inutile d'hydrater) comme du bleu de toluidine-éosine (temps de coloration : 5 à 15 minutes selon la taille de l'embryon) en surcolorant légèrement ;
- différencier la coloration dans de l'alcool à 95° ou à 70° : la différenciation est terminée quand l'aire vasculaire est rose (et les vaisseaux sanguins bleus s'ils existent déjà) et l'embryon bleu.
- le montage nécessite :
- réaliser deux bains (10 à 15 min) dans de l'éthanol à 100°, la déshydratation étant améliorée par addition d'acétone dans le second bain (intéressant pour des embryons de plus de 3 jours) ;
- éliminer l'éthanol à 100° et immerger l'embryon dans du toluène jusqu'à ce que celui-là devienne transparent (un bain supplémentaire d'acétone entre l'éthanol à 100° et le toluène améliore la déshydratation) ;
- monter l'embryon entre lame et lamelle après 10 min dans le toluène, dans du baume du Canada ou de l'Eukitt (pour éviter la formation de bulles d'air, tremper rapidement la lamelle dans le toluène avant de la mettre en place).
- ce montage pourra être réutilisé si l'on aborde plus tard le plan d'organisation des Vertébrés.
Cette opération nécessite savoir-faire, outils fins et une bonne loupe binoculaire ! Elle ne pourra donc pas être réalisée par les élèves. Il s'agit de sectionner le cœur de part et d'autre de l'anse qu'il forme et de le placer dans du Tyrode. Le cœur isolé peut ainsi battre 3 heures à température ambiante ; toutefois la fréquence diminue progressivement (le replacer éventuellement à 39°C)..
En démonstration sous un vidéomicroscope à faible grossissement, cette observation illustre :
- l'automatisme cardiaque, de façon spectaculaire (cœur isolé dans sa totalité ; demi-cœur isolé ; quart de cœur isolé) ;
- la circulation des hématies, nettement visible.
Vidéo de cœur isolé en totalité (fichier .avi
de 675 ko)
Vidéo d'une moitié de cœur
isolée (fichier .avi de 167 ko)
Vidéo d'un quart de cœur
isolé (fichier .avi de 524 ko)
- Composition du Tyrode simple (suffisant pour cette manipulation) pour 1
litre :
- CaCl2 : 0.15g, à dissoudre en premier, avant d'ajouter les autres sels (sinon on n'arrive pas à le dissoudre)
- NaCl : 6g
- KCL : 0.15g
- MgCl2 : 0.075g
- NaH2PO4 : 0.037g
- glucose : 1g
- H2O distillée QSP 1000 mL
Stériliser si possible à l'autoclave (ou à la cocotte minute !) pendant 20 min (pour la stérilisation ne pas fermer les flacons à fond sinon ils explosent !).
Se conserve à température ambiante.
Si non stérilisé : conservation au réfrigérateur.
Remarque : le Tyrode doit être à la température de l'embryon, donc entre 35 et 40 °C si on désire obtenir une bonne activité cardiaque embryonnaire.
- Composition du Tyrode tamponné (pour les cultures d'organes in-vitro ou
le cœur en survie) :
Préparer séparément les 2 solutions :
solution A :
- CaCl2 : 0.2g (à dissoudre en premier)
- NaCl : 8g
- KCl : 0.2g
- MgCl2 : 0.1g
- NaH2PO4 : 0.05g
- glucose : 1g
- H2O distillée : QSP 850 mL
solution B
- NaHCO3 : 1g
- H2O distillée : QSP 150 ml
Stériliser les 2 solutions à l'autoclave 20 min, les mélanger seulement au moment de l'emploi.
- Composition du fixateur de Clarke :
- acide acétique : 1 volume
- éthanol absolu : 3 volumes
- Bleu de toluidine-éosine (colorant) :
- bleu de toluidine : 1 g
- éosine : 0,2 g
- eau distillée : 100 mL
4.5. Compositions des liquides utilisés