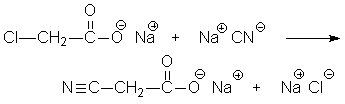
Nomenclature
1. Écrire toutes les formules des tribromocyclohexanes. On fera apparaître tous les stéréoisomères.
2. Proposer une structure en accord avec les données RMN suivantes, obtenues pour un composé C4H8Br2 :
– singulet à 1,9 ppm (6p)
– singulet à 3,9 ppm (2p)
3. Un dérivé bromé a le spectre RMN suivant : (sa masse molaire est 199)
¨ quintuplet à 2,2 ppm ¨ triplet à 2,7 ppm ¨ triplet à 3,4 ppm ¨ singulet à 7,3 ppm.
Attribuer les multiplets et donner la structure développée du composé.
Nucléophilies
4. Comparer le pouvoir nucléophile de : H2O , OH– , CH3O – , CH3 – COO –
Idem entre NH3 et PH3 .
5. L’hydrolyse des halogénures d’alkyle primaires en alcool est généralement lente. Toutefois, l’addition de KI (catalytique) accélère la réaction. Pourquoi ?
6. Soit la réaction de substitution nucléophile suivante :
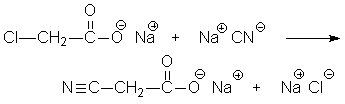
Pourquoi utilise-t-on le sel de sodium de l’acide chloroacétique et non l’acide lui-même?
Structure du substrat
7. Pourquoi le chlorure de néopentyle
,
![]() ,
un halogénure primaire, ne subit-il pas de réactions SN2 typiques ?
,
un halogénure primaire, ne subit-il pas de réactions SN2 typiques ?
8. Expliquer pourquoi le 1-chloro-prop-2-ène est plus rapidement solvolysé que le 2-chloro-2-méthyl-propane .
9. Quelles sont les vitesses relatives des réactions de SN de l’ion éthylate (éthanolate) avec :
12.1. CH3Br |
12.2. F—Br | 12.3. CH3CH2–Br | 12.4. |
| 12.5. CH2 = CH – CH2Br | 12.6. CH2 = CH – Br | 12.7. |
12.8.  |
10. En présence d’éthylate de sodium dans l’éthanol, lequel des deux composés réagit le plus vite ? Quels sont les produits obtenus ?
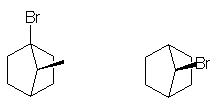
11. Compléter et expliquer les réactions suivantes sachant que A et B ont pour formules brutes C10H18 :
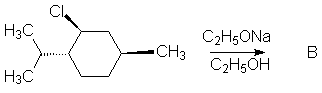
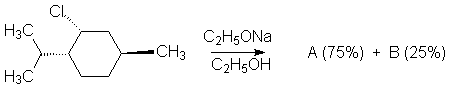
12. Même question pour l’eau avec :
| 13.1. F–CH2Br | 13.2. para-O2N–F–CH2Br |
| 13.3. para-H3C–F–CH2Br | 13.4. para-H3C–O–F–CH2Br |
13. Le 1-bromo-1,2-diphényl propane 1(S), 2(S) est traité par une base forte à chaud. Écrire la réaction et préciser l’isomère obtenu.
14. Quel isomère obtient-on par réaction du 2-bromo-3-méthyl pentane 2(R), 3(S) avec de la potasse dans l’éthanol et à chaud?
Participation du groupe voisin et transpositions
15. Donner ou expliquer la configuration absolue des produits obtenus dans la réaction suivante : (On obtient, en plus du composé attendu, le 1,2-diphényl 1-méthoxypropane et le 1,1-diphényl 2-méthoxypropane)
1-bromo-1,2-diphényl-propane R,R + CH3O – ®
16. La solvolyse du 1-iodo-4-méthoxy-cyclohexane-trans par les ions acétate dans l’eau donne surtout l’acétate de 4-méthoxy-cyclohex-1-yle-trans .
7.1. Que devrait-on obtenir normalement ?
7.2. Quel est le phénomène qui est à l’origine de cette rétention de configuration ?
7.3. Quel est l’atome de la molécule capable de provoquer ce phénomène ?
7.4. Quelle doit être la conformation du cyclohexane pour que ce phénomène ait lieu ?
17. Le 3-chloro but-1-ène, traité par des ions OH–, donne un mélange de deux alcools. On obtient le même mélange en partant du 1-bromo but-2-ène. Expliquer pourquoi.
17bis
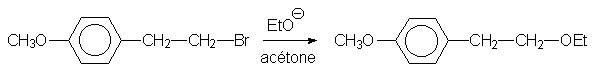
On appelle V1 la vitesse de cette première réaction.
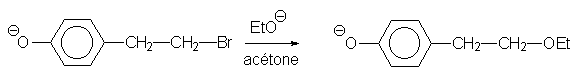
On appelle V2 la vitesse de cette seconde réaction.
Expliquer le fait que V2 = 106 ´ V1
Mécanismes
18. Indiquer les différences entre les états de transition SN1 et SN2 .
19. On fait réagir HCl sur les composés suivants :
11.1. Butan-1-ol
11.2. 2-méthyl propanol
11.3. bicyclo[2.2.1]heptan-1-ol
En déduire les mécanismes de ces réactions. On observe k3 << k1 ou k2. Pourquoi?
20. Le 2-bromo butane 2(R) est traité par l’éthanoate de sodium en solution dans l’éthanol, à température moyenne. Après réaction, deux produits A et B, dont les formules brutes sont différentes, sont isolés. On suppose que les réactions conduisant à A et B sont du second ordre. Donner le mécanisme des réactions ainsi que les formules de A et B. Quelle sera la stéréochimie des produits obtenus ?
21. Étude de réactions d’hydrolyse de dérivés halogénés R–X .
21.1. Les vitesses relatives de réaction en fonction de R sont données dans le tableau suivant :
R |
CH3– |
CH3–CH2– |
CH3–CH2–CH2– |
|
rapport des vitesses sur la vitesse obtenue avec Et – X |
30 |
1 |
0,4 |
0,03 |
Écrire le mécanisme réactionnel compatible avec ces résultats. Justifier.
21.2. Dans des conditions opératoires différentes, on obtient les résultats suivants pour les vitesses relatives en fonction de R et du solvant. On donne le rapport vRX /vEtX
| R | CH3 – CH2 – |
|
|
| alcool à 60 % | 1 |
1,78 |
2,41.104 |
| eau | 1 |
11,6 |
1,2.106 |
Écrire le mécanisme réactionnel compatible avec ces résultats.
Justifier votre réponse en analysant l’influence de la nature de R et du solvant.
21.3. Dans le cas du bromure de méthyle, la vitesse de réaction est multipliée par 5000 lorsqu’on remplace le réactif nucléophile H2O par OH– dans l’eau. Par contre, le changement de réactif ne modifie pas la vitesse dans le cas du 2-bromo-2-méthyl-propane. Expliquer pourquoi.
22. La réaction du bromure de tertiobutyle, en solution dans l’acide acétique, est la suivante :
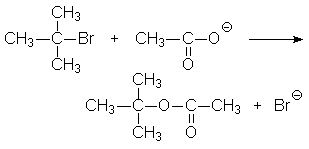
22.1. Quel est le type de cette réaction ?22.2. L’addition d’acétate de sodium au mélange réactionnel ne modifie pas la vitesse de la réaction. Que peut-on en conclure quant au mécanisme de cette réaction ?
23. Quels sont les produits obtenus dans les réactions suivantes ?
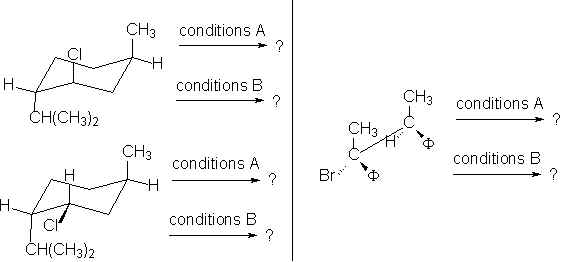
* Conditions A : EtO– dans EtOH à 100°
* Conditions B : H2O à 100°C
24. Le 2-chloro-2-méthyl propane est traité par CH30H / H20. Donner les produits obtenus et expliquer.
25. Quand on chauffe le 2-bromo-3-méthyl-butane
avec HBr, on obtient un composé dont le spectre RMN est donné ci-contre. Quel est ce
produit ? (avec l’interprétation) ?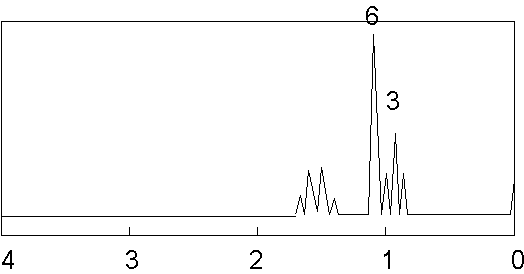
26. Expliquer le résultat suivant :
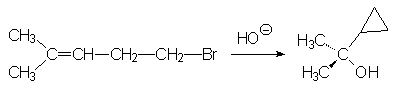
Synthèses
27. Quels sont les produits de substitution obtenus dans les réactions suivantes (y compris étude stéréochimique) :
27.1. trans 1-chloro-3-méthyl cyclopentane (SS) + OH –
27.2. 1-chloro-1-phényléthane (S) + Na +,CH3O – dans le méthanol
27.3. 1-chloro-1-phényléthane (S) + H2O
28. Compléter les réactions suivantes :
1-bromo butane + cyanure de sodium -----
2-chloro propane + éthanolate de sodium + chaleur -------
2-bromo-2-méthyl pentane + NaOH alcoolique + chaleur -------
2-chloro, hexane + NaOH aq + chaleur modérée ---------
29. En partant du 1-bromo-butane, synthétiser :
| 29.1. CH2 = CH–CH2–CH3 | 29.2. CH3 – CH = CH – CH3 (E) |
| 29.3. CH3 – CH = CH – CH3 (Z) | 29.4. CH3 – C º C – CH3 |
| 29.5. HC º C – CH2 – CH3 | 29.6. CH3 – CHBr – CH2 – CH3 |
| 29.7. CH3 – CH2 – CH2 – CH2 – SH | 29.8.CH3 – CH2 – CH2 – CH2 – Cº N |
30. Quels sont les produits obtenus dans les réactions suivantes ?
30.1. 2,3-dibromo-butane thréo-S,S + Mg dans l’éther
30.2. 2-chloro-propane + Na dans le pentane.
31. Quel est le produit principal dans les réactions suivantes :
31.1. 1-(N,N-diméthylamino)-3-bromo-4-nitrobenzène + OH –
31.2. 3-bromo-oxanne (cycle oxygéné saturé à 6 chaînons, O ayant le n° 1) + Zn puis hydrolyse en milieu acide.
31.3. phényléthyne + ![]() puis traitement par du 1-bromo-propane
puis traitement par du 1-bromo-propane
31.4. cyclopentène + bromoforme en présence de tertiobutylate de potassium.
32. Synthétiser les composés suivants à partir de l’éthène et de tout composé minéral :
propanonitrile |
pentan-3-one | acide propanoïque | 3-éthyl-pentan-3-ol |
| 3,3-diéthyl-pentan-1-ol | butane | but-1-ène | octane |
33. Compléter les réactions suivantes :
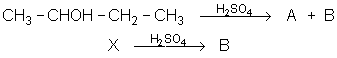
34. Comment peut-on passer du 2,3-diméthyl cyclohexène au 1,2-diméthyl cyclohexène?
Stéréochimie
35. Le 1-bromo-3-méthyl cyclopentane, traité par de la potasse dans l’éthanol à chaud, donne plusieurs produits. Écrire les formules développées et donner leur action sur la lumière polarisée.
36.7. Le pouvoir rotatoire spécifique
![]() à 25°C du (S)–(+)–3-bromo-octane
optiquement pur
est + 36,0° . Si l’on en fait réagir un échantillon
partiellement racémisé de rotation spécifique + 30° avec de la soude NaOH
diluée, il se forme du (R)–(-)–octan-3-ol (
à 25°C du (S)–(+)–3-bromo-octane
optiquement pur
est + 36,0° . Si l’on en fait réagir un échantillon
partiellement racémisé de rotation spécifique + 30° avec de la soude NaOH
diluée, il se forme du (R)–(-)–octan-3-ol (![]() ) ; le
pouvoir rotatoire spécifique de cet alcool à 25°C, à l’état pur, est égal à
–10,3°.
) ; le
pouvoir rotatoire spécifique de cet alcool à 25°C, à l’état pur, est égal à
–10,3°.
36.1. Représenter l’équation de la réaction en faisant appel aux projections en perspective et de Fischer.
36.2. Calculer le pourcentage d’énantiomère optiquement actif (lequel est-ce?) du réactif et du produit.
36.3. Calculer le pourcentage d’inversion et celui de racémisation.
36.4. Tirer une conclusion concernant les réactions des halogénures d’alkyle secondaires.
36.5. Quels changements dans les conditions opératoires favoriseraient une augmentation de l’inversion ?
37. Commenter les valeurs des pouvoirs rotatoires spécifiques dans les composés suivants, en montrant le mécanisme suivi :
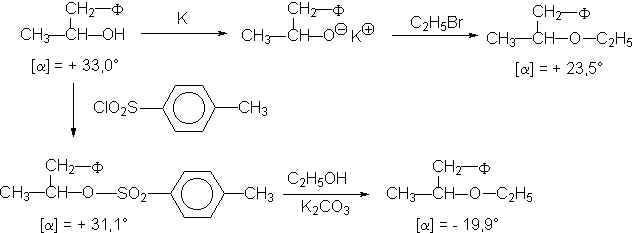
À quoi sert ![]() ?
?
38. Expliquer la rétention de configuration lors de la réaction suivante :
![]()